
| |||||||||||
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
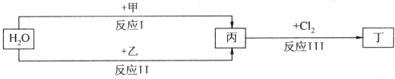
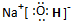
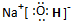
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2012年人教版高中化学必修二 1.1元素周期表练习卷(解析版) 题型:选择题
X、Y是元素周期表ⅠA族中的两种金属元素,下列叙述中能说明X的金属性比Y强的是( )
A.Y与水反应比X与水反应更剧烈 B.Y+离子的氧化性比X+离子强
C.YOH的碱性比XOH强 D.Y的原子半径比X大
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:
(15 分)
A、B、C、D均是前四周期元素组成的单质或化合物。它们之间有如下转化关系:
![]()
(1) 若A是某矿石的主要成份,上述转化关系表示工业生产D的过程,且反应②在接触室中进行,反应①在______(填设备名称)中进行。工业上使用______吸收C,以提高吸收效率。
(2) 若D是能使澄清石灰水变浑浊的无色无味气体,A、B为两种单质,组成它们的元素原子序数之和为18,②、③均为化合反应,则反应①中氧化剂与还原剂的质量之比为______
(3) 若A、B、C、D均含有同一种常见金属元素,B是黑色磁性固体,D是一种红褐色沉淀,反应②在常见稀酸中进行,C是该反应中生成的唯一盐,反应②的离子方程式是______检验C中金属阳离子的常见试剂是______(填名称)。
(4) 若A、B、C、D均含有同一种短周期的金属元素,且B和D在溶液中反应生成沉淀C,则下列判断正确的是______ (填字母)。
a. A可能是一种耐火材料;
b. B的溶液一定呈碱性;
c. C 一定既溶于盐酸又溶于苛性钠溶液;
则B与D在溶液中反应的离子方程式为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com