
【题目】研究性学习的本质在于,让学生亲历知识产生与形成的过程。我校某化学研究性学习小组欲以CO2为主要原料,采用下图所示装置模拟“侯氏制碱法”制取NaHCO3,并对CO2与NaOH的反应进行探究.
【资料获悉】“侯氏制碱法”原理:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,然后再将NaHCO3灼烧制成Na2CO3.
【实验设计】如图1所示

【实验探究】
(1)装置乙的作用是 .
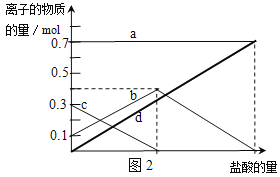
(2)若在NaHCO3灼烧中时间较短,NaHCO3将分解不完全.取经短暂加热的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中有关离子的物质的量的变化如图2所示.则曲线b对应的溶液中的离子是 (填离子符号);该样品中Na2CO3和NaHCO3的物质的量之比是 。
(3)若将装置甲产生的纯净的CO21.68L(标准状况下)缓慢地全部通入到100mL NaOH溶液中,充分反应后,将溶液低温蒸干,得到不含结晶水的固体W,其质量为7.4g,则W的成分为 (填化学式),原NaOH溶液的物质的量浓度为 。
【答案】(1)除去CO2中的HCl (2)HCO3﹣; 3﹕1;(3)Na2CO3和NaHCO3; 1.25 mol/L
【解析】
试题(1)在装置甲中发生反应制取CO2气体,由于盐酸有挥发性,所以在CO2气体中含有杂质HCl,装置乙的作用是除去二氧化碳中的氯化氢气体。
(2)向含有Na2CO3、NaHCO3的混合物中加入盐酸,会发生反应:Na2CO3+ HCl=NaCl+ NaHCO3 ,所以n(CO32-)会逐渐减少,当该反应恰好完全时,n(CO32-)=0,用c表示;n(HCO3-)首先会逐渐增多,当该反应恰好完全时,n(HCO3-)达到最大值,后会发生反应:NaHCO3+HCl=NaCl+H2O+ CO2↑n(HCO3-)由消耗而逐渐减少,最后为0 ,用b表示;而n(Na+)的物质的量始终保持不变,用a表示;n(Cl-)则会随着盐酸的加入而逐渐增多,因此用d表示;则曲线b对应的溶液中的离子是HCO3-。根据图示可知n(Na2CO3)=0.3mol,n(NaHCO3)=0.4mol—0.3mol =0.1mol,该样品中NaHCO3和Na2CO3的物质的量之比是3:1;
(3)n(CO2)=1.68L÷22.4L/mol=0.075mol,将其通入100mLNaOH溶液中,若完全转化为Na2CO3,根据C守恒可得质量是0.075mol×106g/mol=7.95g,若完全转化为NaHCO3,其质量是0.075mol×84g/mol=6.3g,现在得到的固体质量是7.95g>7.4g>6.3g,说明是Na2CO3、NaHCO3 的混合物,假设在混合物中Na2CO3、NaHCO3 的物质的量分别是x、y,则根据C守恒可得x+y=0.075;根据质量守恒可得106x+84y=7.4,解得x=0.05mol,y=0.025mol,所以根据Na元素守恒可得n(NaOH)=2n(Na2CO3)+ n(NaHCO3)=2×0.05mol+0.025mol=0.125mol,所以c(NaOH)=0.125mol÷0.1L=1.25mol/L。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】给定条件下,下列选项中所示的物质间在相应条件下转化均能一步实现的是( )
A.SiO2![]() H2SiO3
H2SiO3![]() Na2SiO3(aq)
Na2SiO3(aq)
B.Ca(OH)2![]() Ca(ClO)2
Ca(ClO)2![]() HClO
HClO
C.MgCl26H2O![]() MgCl2
MgCl2![]() Mg
Mg
D.N2![]() NO2
NO2 ![]() HNO3
HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示。下列说法正确的是( )
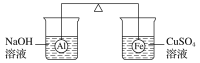
A.铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡
B.铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,杠杆右边下沉
C.反应后去掉两烧杯,杠杆仍平衡
D.右边球上出现红色,左边溶液的c(OH-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是单质,其中A是金属,各种物质间的转化关系如图。根据图示转化关系回答:
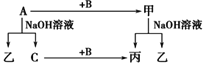
(1)写出下列物质的化学式。
A________,B________,甲_________,乙________。
(2)写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式________________________________。
②甲与NaOH溶液反应的离子方程式________________________________。
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为________,转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结构决定性质,有机化合物的结构也是研究有机物性质的基础。
(1)烷基是烷烃失去一个或若干氢原子后剩下的电中性的原子团,请在方框内写出甲基的电子式_______。

(2)有一类有机物,它的一卤代物只有一种,如![]() 、
、![]() 等。请写出另外两种满足该条件烷烃的结构简式,并用系统命名法命名。
等。请写出另外两种满足该条件烷烃的结构简式,并用系统命名法命名。
结构简式 | _______ | _______ |
系统命名 | _______ | _______ |
(3)烷烃都是由共价键形成的有机物,若用I表示一个烷烃分子中的共价键数,n表示该烷烃的碳原子数,则丙烷(![]() )的共价键数
)的共价键数![]() ____________﹔若某烷烃的共价键数
____________﹔若某烷烃的共价键数![]() ,则
,则![]() ____________。
____________。
(4)烃的结构主要由碳原子的连接顺序决定,因此我们常通过键线式来表示烃的结构,其中每个端点和拐角都代表一个碳,每个碳原子连接的氢原子都不表示出来。A、B、C分别表示三种物质的空间立体结构:
A. 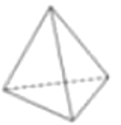 B.
B.  C.
C. 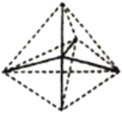
①上述结构中的C不可能是烃,理由是______________________________。
②B分子的分子式是__________________,其一氯代物共有____________种。
③在结构A的每两个碳原子之间插入一个![]() 原子团,可以形成金刚烷的结构,写出金刚烷的分子式__________________。
原子团,可以形成金刚烷的结构,写出金刚烷的分子式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种肼燃料电池的结构如图所示,下列说法正确的是( )
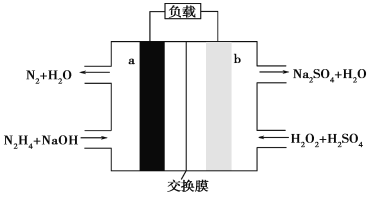
A. a极是正极,电极反应式为N2H4-4e-+4OH-=N2↑+4H2O
B. 电路中每转移NA个电子,就有1mol Na+穿过膜向正极移动
C. b极的电极反应式为H2O2+2e-=2OH-
D. 用该电池作电源电解饱和食盐水,当得到0.1mol Cl2时,至少要消耗0.1mol N2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里,用足量的浓盐酸与一定量的高锰酸钾反应(不加热),来制取氯气。
反应:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
(1)“双线桥法”标出电子转移情况________。
(2)若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
①理论上需要多少克KMnO4参加反应?________。
②被氧化的HCl的物质的量为多少?________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图表示可逆反应A(s)+B(g) n C(g);ΔH=Q kJ·mol1,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述中一定正确的
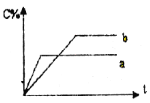
A. 若条件为催化剂,则a表示有催化剂,b表示没有催化剂
B. 只改变温度,则a比b的温度高,且Q>0
C. 只改变压强,则a比b的压强大,n>2
D. 由图象可以作出判断,反应一定从正反应方向开始
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如图装置制得氯气并与铝粉反应制备无水AlCl3。已知AlCl3在183°C升华,遇潮湿空气即反应产生大量白雾。请回答问题:
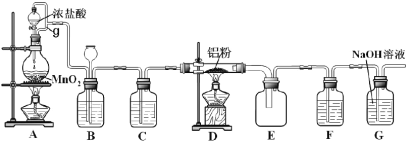
(1)A中反应的化学方程式为_________;HCl在反应中表现出的性质为______(填:酸性、氧化性或还原性)。
(2)A中g管的作用是________。
(3)B中盛放饱和食盐水的作用是________;若D中生成的AlCl3凝华堵塞导管,B中可观察到的现象为________。
(4)C和F所装试剂相同,其中F的作用是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com