
【题目】已知NO2和N2O4可以相互转化:2NO2(g) ![]() N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是
N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是

A.图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d
C.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4
D.若要达到与d相同的状态,在25 min时还可以采取的措施是适当缩小容器体积
科目:高中化学 来源: 题型:
【题目】某种兴奋剂的结构简式如图所示,有关该物质的说法不正确的是 ( )
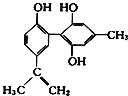
A.该分子中的所有碳原子可能共平面
B.该物质在一定条件下能发生加聚反应
C.滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键
D.1 mol该物质与足量浓溴水反应时最多消耗Br2为4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,已知水的电离方程式是H2O![]() H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
A.水的电离程度只受温度的影响
B.向水中加入少量盐酸,c(H+)增大,Kw不变
C.粒子![]() 对水的电离平衡不会产生影响
对水的电离平衡不会产生影响
D.向水中加入少量固体NH4Cl,平衡向逆反应方向移动,pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn是一种应用广泛的金属。用闪锌矿(主要成分为ZnS,还含有SiO2和少量FeS、CdS、PbS、砷化合物杂质等)为原料制备金属Zn和ZnSO4·7H2O的流程如图所示:
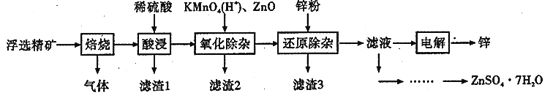
①相关金属离子[c(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
回答下列问题:
(1)滤渣1的主要成分除SiO2外还有______,焙烧后产生的气体对环境造成的常见危害为______。
(2)氧化除杂工序中加入ZnO的作用是___________。
(3)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用的试剂为____________。
(4)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为___________。不能省去“还原除杂”步骤,直接在“氧化除杂”步骤中除去Cd2+,理由是________。
(5)回收所得的Cd可用于制造镍镉碱性二次电池,电池工作时,正极NiO(OH)转化为Ni(OH)2,则充电时电池的阳极反应式为_____________;沉积锌后的电解液可返回______工序继续使用。
(6)酸浸液中砷元素以AsO33-存在,在氧化除杂时加入酸性KMnO4溶液,KMnO4可与AsO33-发生反应生成FeAsO4,写出该反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)请完成FeO42-与水反应的离子方程式:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+__。K2FeO4在处理水的过程中所起的作用是___和____。
4Fe(OH)3+8OH-+__。K2FeO4在处理水的过程中所起的作用是___和____。
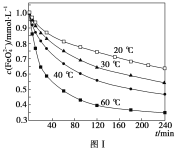
(2)将适量K2FeO4配制成c(FeO42-)=1.0mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。第(1)题中的反应为FeO42-变化的主反应,则温度对该反应的反应速率和平衡移动的影响是___,发生反应的ΔH___0。
Ⅱ.下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
电解质 | 平衡方程式 | 平衡常数K | Ksp |
CH3COOH | CH3COOH | 1.76×10-5 | |
H2CO3 | H2CO3 HCO3- | K1=4.31×10-4 K2=5.61×10-11 | |
C6H5OH | C6H5OH | 1.1×10-10 | |
H3PO4 | H3PO4 H2PO4- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
NH3·H2O | NH3·H2O | 1.76×10-5 | |
BaSO4 | BaSO4 | 1.07×10-10 | |
BaCO3 | BaCO3 | 2.58×10-9 |
回答下列问题:
(1)由上表分析,若①CH3COOH,②HCO3-,③C6H5OH,④H2PO4-均可看做酸,则它们酸性由强到弱的顺序为___(填编号)。
(2)写出C6H5OH与Na3PO4反应的离子方程式___。
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)__c(NH4+)(填“>”、“=”或“<”)。
(4)25℃时,向10mL0.01mol·L-1苯酚溶液中滴加VmL0.01mol·L-1氨水,混合液中粒子浓度关系正确的是__。
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度小于10mL0.01mol·L-1苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+2c(NH4
(5)水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应: 3A(g)+B(g) ![]() 2C(g)+xD(g) ,已知达到平衡时生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g) ,已知达到平衡时生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
A.x=3
B.A的转化率为50%
C.平衡时B的浓度为1.5 mol·L-1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的95%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.NaClO溶液中通入少量CO2,ClO﹣水解程度增大,溶液碱性增强
B.铁片镀锌时,铁片与外电源的正极相连
C.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)能自发进行,则ΔH<0
D.t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)![]() NO(g)+SO3(g),通入少量O2,
NO(g)+SO3(g),通入少量O2,![]() 的值及SO2转化率不变
的值及SO2转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下将1mol N2和2molH2的混合气体通入1L密闭容器中,在一定条件下发生反应,达到化学平衡时,测得混合气体中N2的物质的量为0.5mol。求:
(1)平衡时H2的转化率_______________。
(2)此温度下反应N2 (g) + 3H2(g)![]() 2NH3 (g)的平衡常数_______________。
2NH3 (g)的平衡常数_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和 I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是
2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是
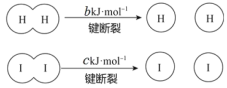
A.反应物的总能量高于生成物的总能量
B.断开 1 mol H—H 键和 1 mol I—I 键所需能量大于断开 2 mol H—I 键所需能量
C.断开 2 mol H—I 键所需能量约为(c+b+a)kJ
D.向密闭容器中加入 2 mol H2 和 2 mo l I2,充分反应放出的热量小于 2a kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com