
| A. | n=1.0 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | c点:c(NH4+)=c(Cl-)=1.0mol•L-1 | |
| D. | 25℃时,NH4Cl的水解常数(Kh)=(n-1)×10-7 |
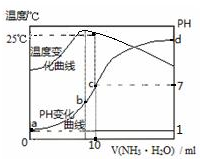
分析 A.酸碱中和反应是放热反应,反应过程中会导致溶液温度升高,弱电解质的电离是吸热过程,一水合氨是弱电解质,所以一水合氨电离过程中吸收热量,当温度最高时氨水和盐酸恰好完全反应,二者的物质的量相等;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中c(H+)或碱中c(OH-)越大,其抑制水电离程度越大;
根据图知,a点溶液中没有滴加氨水,溶质为HCl,b点溶液温度最高,说明二者恰好完全反应生成氯化铵,所以溶质为NH4Cl,NH4Cl溶液呈酸性,要使混合溶液呈中性,则氨水应该过量,所以c点溶液中溶质为NH4Cl和NH3.H2O,d点溶液中溶质为NH4Cl和NH3.H2O,且c(NH4Cl)<c(NH3.H2O);
C.c点溶液呈中性,则c(NH4+)=c(Cl-),因为溶液体积是盐酸的二倍,所以c(Cl-)是原来的一半;
D.c点溶液呈中性,c(H+)=c(OH-)=10-7 mol/L,则c(NH4+)=c(Cl-),因为溶液体积是盐酸的二倍,所以c(Cl-)是原来的一半,则c点c(NH4+)=c(Cl-)=0.5 mol/L,c点溶液中c(NH3.H2O)=0.5nmol/L-0.5mol/L,水解平衡常数Kh=$\frac{{K}_{w}}{{K}_{b}}$.
解答 解:A.酸碱中和反应是放热反应,反应过程中会导致溶液温度升高,弱电解质的电离是吸热过程,一水合氨是弱电解质,所以一水合氨电离过程中吸收热量,当温度最高时氨水和盐酸恰好完全反应,二者的物质的量相等,根据图知,二者完全反应时氨水体积小于10mL,则氨水浓度大于1.0mol/L,即n>1.0,故A错误;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中c(H+)或碱中c(OH-)越大,其抑制水电离程度越大;
根据图知,a点溶液中没有滴加氨水,溶质为HCl,b点溶液温度最高,说明二者恰好完全反应生成氯化铵,所以溶质为NH4Cl,NH4Cl溶液呈酸性,要使混合溶液呈中性,则氨水应该过量,所以c点溶液中溶质为NH4Cl和NH3.H2O,d点溶液中溶质为NH4Cl和NH3.H2O,且c(NH4Cl)<c(NH3.H2O),
a点、d点抑制水电离,且a点抑制水电离程度大于d;
b、c点促进水电离,但b点促进水电离程度大于c;
所以水电离程度大小顺序是b>c>d>a,
故B错误;
C.c点溶液呈中性,则c(NH4+)=c(Cl-),因为溶液体积是盐酸的二倍,所以c(Cl-)是原来的一半,为0.5mol/L,故C错误;
D.c点溶液呈中性,c(H+)=c(OH-)=10-7 mol/L,则c(NH4+)=c(Cl-),因为溶液体积是盐酸的二倍,所以c(Cl-)是原来的一半,则c点c(NH4+)=c(Cl-)=0.5 mol/L,c点溶液中c(NH3.H2O)=0.5nmol/L-0.5mol/L,水解平衡常数Kh=$\frac{{K}_{w}}{{K}_{b}}$=$\frac{1{0}^{-14}}{\frac{0.5×1{0}^{-7}}{0.5n-0.5}}$=(n-1)×10-7,故D正确;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断及计算能力,明确图中曲线上各个点的溶质成分及其性质、物质的量浓度相对大小是解本题关键,难点是水解平衡常数的计算,注意c点混合溶液中一水合氨浓度的计算,题目难度中等.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
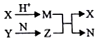 短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )| A. | 相对分子质量M>N,沸点N<M | B. | .简单离子半径:D>B>C>A | ||
| C. | Z为Na2CO3 | D. | .图中有两个氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 实验序号 | I | II | III | IV |
| NaOH溶液的体积(mL) | 50.0 | 50.0 | 50.0 | 50.0 |
| 样品质量(g) | 3.44 | m | 17.2 | 21.5 |
| NH3体积(L) | 1.12 | 2.24 | 5.60 | 5.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验序号 | ① | ② | ③ | ④ |
| 盐酸体积/mL | 50 | 50 | 50 | 50 |
| 固体质量/g | 3.06 | 6.12 | 9.18 | 12.24 |
| 生成气体体积/L(标况) | 0.672 | 1.344 | 1.568 | 1.344 |
| A. | 盐酸的物质的量浓度为 2 mol•L-1 | |
| B. | 原混合物样品中 n(Na2CO3):n(KHCO3)=1:1 | |
| C. | 实验②中,混合物过量 | |
| D. | 实验④反应后,至少需继续加入 40ml 的该盐酸溶液才能把12.24g 的混合物全部反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
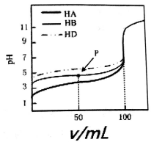
| A. | HA、HB和HD均为弱酸 | |
| B. | P点时,c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) | |
| C. | pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) | |
| D. | 三种酸溶液分别被NaOH溶液恰好完全中和后互混:c(HA)+c(HB)+c(HD)═c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
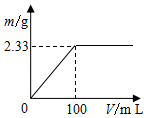 分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份.
分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、氯乙烯、聚乙烯均可以使酸性高锰酸钾溶液褪色 | |
| B. | 1mol苹果酸[HOOCCH(OH)CH2COOH]可与3molNaHCO3发生反应 | |
| C. | 酸性条件下,C2H5CO18OC2H5的水解产物是C2H5CO18OH和C2H5OH | |
| D. | 有机物分子式为C4H7ClO2,与NaHCO3溶液反应产生CO2,其结构可能有5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com