
【题目】新旧动能转换工程之一是新能源新材料的挖掘和应用。乙二醇是重要的化工原料, 煤基合成气(CO、 H2)间接制乙二醇具有转化率高、回收率高等优点,是我国一项拥有自主知识产权的世界首创技术,制备过程如下:
反应 I: 4NO(g)+4CH3OH(g)+O2(g) ![]() 4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
反应 II: 2CO(g)+2CH3ONO(g) ![]() CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
反应 III: CH3OOCCOOCH3(1)+4H2(g) ![]() HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
(1)请写出煤基合成气[n(CO): n(H2)= 1:2]与氧气间接合成乙二醇(HOCH2CH2OH)的总热化学方程式:________________________________________,该反应在较低温条件下能自发进行,则ΔH______0 (填“>”、“<”或“=”)。
(2)一定温度下,在 2 L 的密闭容器中投入物质的量均为 0.4mol的CO 和 CH3ONO发生反应 II,10min 达到平衡时CO的体积分数与NO的体积分数相等。
①下列选项能判断反应已达到化学平衡状态的是________。
a. 混合气体总物质的量不再变化
b. 混合气体的密度不再变化
c. 单位时间内生成 CO 和 NO 的物质的量相等
d. CO 和 CH3ONO 的浓度比不再变化
②若此时向容器中再通入0.4 mol NO,一段时间后,达到新平衡时 NO的体积分数与原平衡时相比______(填“增大”“相等”“减小”或“不能确定”)。
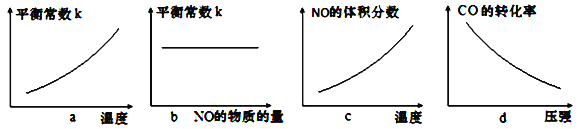
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________(填字母)。
④反应达平衡后向2 L恒容密闭容器中再加入 0.4mol的CO 和 0.4mol NO,化学平衡向________(填“正反应”、“逆反应”或“平衡不移动”)方向移动。
【答案】4H2(g)+2CO(g)+1/2O2(g) ![]() HOCH2CH2OH(l)+H2O(g) △H3=(1/2a+b+c)kJ·mol-1 < a bc 增大 b 平衡不移动
HOCH2CH2OH(l)+H2O(g) △H3=(1/2a+b+c)kJ·mol-1 < a bc 增大 b 平衡不移动
【解析】
(1)根据盖斯定律进行分析;根据G=H-TS<0反应自发进行进行分析;
(2)根据化学平衡状态的判断依据:v(正)=v(逆),各组分的浓度保持不变及由此衍生出的相关物理量结合反应进行分析判断;
(1)反应 I: 4NO(g)+4CH3OH(g)+O2(g) ![]() 4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1;反应 II: 2CO(g)+2CH3ONO(g)
4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1;反应 II: 2CO(g)+2CH3ONO(g) ![]() CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1;反应 III: CH3OOCCOOCH3(1)+4H2(g)
CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1;反应 III: CH3OOCCOOCH3(1)+4H2(g) ![]() HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1;根据盖斯定律,由I×1/2+ II+ III得反应:4H2(g)+2CO(g)+1/2O2(g)
HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1;根据盖斯定律,由I×1/2+ II+ III得反应:4H2(g)+2CO(g)+1/2O2(g) ![]() HOCH2CH2OH(l)+H2O(g) △H3=(1/2a+b+c)kJ·mol-1;该反应为熵减的反应,S<0,已知该反应能够在较低温度下能够自发进行,要使G=H-TS<0,必须满足△H<0;
HOCH2CH2OH(l)+H2O(g) △H3=(1/2a+b+c)kJ·mol-1;该反应为熵减的反应,S<0,已知该反应能够在较低温度下能够自发进行,要使G=H-TS<0,必须满足△H<0;
故答案是:4H2(g)+2CO(g)+1/2O2(g)![]() HOCH2CH2OH(l)+H2O(g) △H3=(1/2a+b+c)kJ·mol-1 ;< ;
HOCH2CH2OH(l)+H2O(g) △H3=(1/2a+b+c)kJ·mol-1 ;< ;
(2)①a.根据2CO(g)+2CH3ONO(g) ![]() CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1反应可知,该反应为气体总量减小的反应,当混合气体总物质的量不再变化,说明反应已达平衡状态,故选;
CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1反应可知,该反应为气体总量减小的反应,当混合气体总物质的量不再变化,说明反应已达平衡状态,故选;
b.该反应在恒容条件下进行且参与物质不完全为气体,根据ρ=m/V可知,反应前后气体的质量发生变化,因此气体的密度为变量,当混合气体的密度不再变化,说明反应已达平衡状态,故选;
c.单位时间内生成CO和NO的物质的量相等,说明正逆反应速率相等,反应达平衡状态,故选;
d.CO和CH3ONO的投料相等且在反应中计量数相等,故两者的浓度比始终不变,不能作为平衡状态的判断依据,故不选;
答案选abc;
②2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l) + 2NO(g)反应10min达到平衡时CO的体积分数与NO的体积分数相等;若此时向容器中再通入0.4 mol NO,恒容条件下相当于增大压强,平衡向气体体积缩小的正方向移动,NO的体积分数增大,故新平衡时NO的体积分数与原平衡时相比增大;
CH3OOCCOOCH3(l) + 2NO(g)反应10min达到平衡时CO的体积分数与NO的体积分数相等;若此时向容器中再通入0.4 mol NO,恒容条件下相当于增大压强,平衡向气体体积缩小的正方向移动,NO的体积分数增大,故新平衡时NO的体积分数与原平衡时相比增大;
故答案是:增大;
③a.该反应为气体计量数减小的放热反应,升高温度,平衡逆向移动,生成物浓度减小,反应物浓度增大,平衡常数减小,选项a错误;
b平衡常数只与温度有关,与浓度无关,故NO的浓度变化,K值保持不变,选项b正确;
c.该反应为放热反应,升高温度平衡逆向移动,NO的体积分数减小,选项c错误;
d.该反应为气体体积缩小的反应,增大压强,平衡正向移动,CO的转化率增大,选项d错误;
故答案选b。
④设平衡转化率为x,则
2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l) + 2NO(g)
CH3OOCCOOCH3(l) + 2NO(g)
开始 0.2 . 0.2 0 0
改变 0.2x 0.2x 0.1x 0.2x
平衡 0.2-0.2x 0.2-0.2x 0.1x 0.2x
10min达到平衡时CO的体积分数与NO的体积分数相等,则0.2-0.2x=0.2x,解得x=0.5;该温度下化学平衡常数K=![]() ;反应达到平衡后,向2 L恒容密闭容器中再加入 0.4mol的CO 和 0.4mol NO,浓度分别为:0.4mol/2 L=0.2mol/L,0.4mol/2 L=0.2mol/L,所以:c(CO)=0.2-0.2×0.5+0.2=0.3mol/L;c(CH3ONO)=0.2-0.2×0.5=0.1mol/L;c(NO)=0.2×0.5+0.2=0.3mol/L;反应的浓度商QC= c2(NO)/ c2(CH3ONO)c2(CO)=0.32/0.12×0.32=100= K,反应达化学平衡不移动;
;反应达到平衡后,向2 L恒容密闭容器中再加入 0.4mol的CO 和 0.4mol NO,浓度分别为:0.4mol/2 L=0.2mol/L,0.4mol/2 L=0.2mol/L,所以:c(CO)=0.2-0.2×0.5+0.2=0.3mol/L;c(CH3ONO)=0.2-0.2×0.5=0.1mol/L;c(NO)=0.2×0.5+0.2=0.3mol/L;反应的浓度商QC= c2(NO)/ c2(CH3ONO)c2(CO)=0.32/0.12×0.32=100= K,反应达化学平衡不移动;
故答案是:平衡不移动。


科目:高中化学 来源: 题型:
【题目】CuCl是应用广泛的有机合成催化剂,可从黄铜矿(主要成分为CuFeS2)中制取。

已知:CuCl是一种白色粉末,微溶于水,难溶于乙醇,在空气中易被氧化,在水溶液中存在平衡:CuCl(s)+2Cl-(aq)[CuCl3]2-(aq)(无色溶液)。下列叙述正确的是
A.“浸取”过程中的主要反应为CuFeS2+4CuCl2=4CuCl+FeCl2+2S
B.浸取所得到的FeCl2溶液,可用来腐蚀覆在绝缘板上的铜箔制造印刷电路板
C.加水有利于CuCl(s) +2Cl-(aq)[CuCl3]2-(aq)平衡逆向移动,析出CuCl,Cl-浓度增大
D.为提高产率和纯度,可采用乙醇洗涤、真空干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2NCOONH4(59℃时升华并分解)可用作磷化铝中间体及医药等。可由干燥的NH3与CO2在低温下(或冰水浴)制取,装置如图所示:
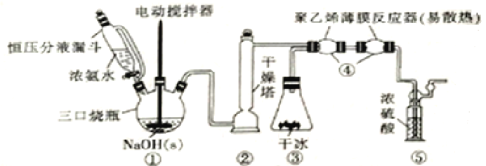
回答下列问题:
(1)装置①中用“恒压分液漏斗”代替普通的分液漏斗,其优点是_____________,滴入浓氨水并搅拌能产生大量NH3的原因是____________________,装置②干燥塔中盛放的合适干燥剂是_____________(填名称)。
(2)装置③用盛干冰装置代替实验室制备CO2的常见制备及纯化转置,其优点除装置简洁且可产生纯净干燥的CO2外,还具有的优点是____________________________________。
(3)装置④用“聚乙烯薄膜反应器”代替反应管的优点是____________,“聚乙烯薄膜反应器”中发生反应的化学方程式为_____________________________________________。
(4)从环境保护角度分析,装置⑤的作用是_____________,还可以通过观察气泡确定NH3和CO2的比例是否合适,判断的依据及不合适时的调节方案为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】17.4g MnO2与240 mL 10 mol/L(密度为1.10g/mL)的盐酸(足量)混合加热(不考虑盐酸挥发),使其充分反应后,再向溶液中加入足量的AgNO3溶液。(已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O)
MnCl2+Cl2↑+2H2O)
试求:(1)10 mol/L的盐酸的质量分数____________
(2)产生的气体在标准状况下的体积______________;
(3)产生沉淀的质量_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480mL含NaClO25%,密度为1.19g/cm3的消毒液.下列说法正确的是
A. 配制过程只需要三种仪器即可完成
B. 容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C. 定容时俯视容量瓶的刻度线,会造成所配溶液物质的量浓度偏低
D. 需用托盘天平称量的NaClO固体的质量为148.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g),下列叙述错误的是
CH3CH2OH(g)+3H2O(g),下列叙述错误的是
A. 反应需在300 ℃进行可推测该反应是吸热反应
B. 使用催化剂可提高反应速率
C. 充入大量CO2气体可提高H2的转化率
D. 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL该溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加足量NaOH溶液加热后,收集到气体0.08mol;
③第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。根据上述实验,回答下列问题:
(1)由第二份进行的实验得知混合物中应含有___________离子,其物质的量浓度为________。
(2)由第三份进行的实验可知12.54克沉淀的成分是______________(写沉淀化学式),其物质的量分别为______________________。
(3)原溶液中是否存在K+_______填“是”或“否)若存在则K+的浓度的取值范围是____________________(若不存在此空可不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是工业上制取纯硅的一种方法。

请回答下列问题(各元素用相应的元素符号表示):
(1)在上述生产过程中,属于置换反应的有____(填反应代号);
(2)写出反应③的化学方程式____;
(3)化合物W的用途很广,通常可用作建筑工业和造纸工业的黏合剂,可作肥皂的填充剂,是天然水的软化剂。将石英砂和纯碱按一定比例混合加热至1 373~1 623 K反应,生成化合物W,其化学方程式是____;
(4)A、B、C三种气体在“节能减排”中作为减排目标的一种气体是___(填化学式);分别通入W溶液中能得到白色沉淀的气体是___(填化学式);
(5)工业上合成氨的原料H2的制法是先把焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,提纯水煤气得到纯净的H2的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1 ①
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1 ②
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:_____________
(2)在25℃、101kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100g CaCO3沉淀,则乙醇燃烧的热化学方程式为____________________________。
(3)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:______________________________________________。
(4)向足量H2SO4溶液中加入100mL 0.4mol·L-1Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4mol·L-1盐酸时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com