
【题目】用电火花点燃装在一密闭容器中的一种气态烃和足量的氧气,完全燃烧后,容器内气体体积保持不变(气体体积均在120℃和相同的压强下测定),这种气态烃不可能是
A.CH4 B.C2H4 C.C3H4 D.C3H6
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程。其设计的模拟装置如下:

根据要求填空:
(1)B装置有三种功能:①均匀混合气体;② ;③ 。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应 。
(3)D装置的石棉中均匀混有KI粉末,其作用是 。
(4)E装置的作用是 (填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(5)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 (填分离方法名称)。
(6)该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为 (填编号)。
A.CH4B.CH3C1 C.CH2C12D.CHCl3E.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度溶液的正确步骤的顺序是:
①把已冷却的溶液用玻璃棒小心引流到容量瓶中;②把称量好的溶质放在烧杯里用水溶解;③轻轻振荡容量瓶,使溶液混合均匀;④洗涤烧杯内壁,把洗涤液全部注入容量瓶;⑤定容;⑥盖紧容量瓶,反复上下颠倒摇匀。
A. ①②③④⑤⑥ B. ②③①④⑤⑥ C. ②①④⑤③⑥ D. ②①④③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、下表是元素周期表的一部分,请回答有关问题:
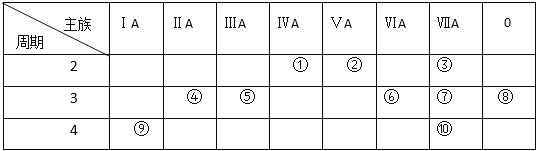
(1)表中能形成两性氢氧化物的元素是 _________ (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式_____________________________。
(2)④元素与⑦元素形成的化合物的电子式 _____________________________。
(3)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 ______。(填化学式)
Ⅱ、A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为: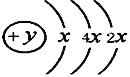 ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空:
(1)A元素在周期表中的位置_____________________________。
(2)A、B、C、D四种元素的原子,半径由小到大的顺序为_______________。
(3)B和C的最高价氧化物对应的水化物反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦
B. 衣服沾上大量的浓氢氧化钠溶液,需将此衣服浸泡在盛水的盆中
C. 皮肤上溅有较多的浓硫酸,直接用水冲洗即可
D. 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于检测环境中NH3的含量,其工作原理示意图如下。

下列说法不正确的是
A. O2在电极b上发生还原反应
B. 溶液中OH+向电极a移动
C. 负极的电极反应式为:2NH3-6e-+6OH-=N2+6H2O
D. 反应消耗的NH3与O2的物质的量之比为4:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠、碳酸氢钠是日常生产生活中常用的两种盐。在实验室中制取NaHCO3的方法有多种。请
依据下列方法回答问题:
方法一:模拟工业“侯氏制碱法”制取:(原理NaCl+H2O+CO2+NH3 = NaHCO3↓+NH4Cl)
第一步:连接好装置,检验气密性,在仪器内装人药品。
第二步:让某一装置先发生反应,直到产生的气体不能再在Ⅲ中溶解,再通入另一装置中产生的气体,片刻后,Ⅲ中出现固体。继续向Ⅲ中通入两种气体,直到不再有固体产生。
第三步:分离Ⅲ中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。
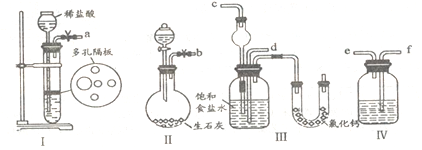
(1)图中所示装置的连接顺序是:a接f;e接________;b接_________(填接口编号)。
(2)I中盛放稀盐酸的仪器名称是_____________,IV中应选用的液体为________________。
(3)第二步中让_____________ (填序号)装置先发生反应。
(4)第四步中所加固体粉末为________。所得的晶体中常含有少置的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4Cl。简要写出操作和现象______________________。
方法二:把CO2通人饱和Na2CO3溶液制取NaHCO3。装置如下图所示(气密性已检验,部分夹持装置略):

(5)请结合化学平衡移动原理解释B中溶液的作用_________________。
(6)当C中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(取一定量的固体,配成溶液作为样液,其余固体备用):
①方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是________________。
②方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com