
【题目】取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为( )
A. 1:6 B. 2:3 C. 3:2 D. 1:1
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量。称取1.59 g样品,溶于水配成250.00 mL溶液,取出该溶液25.00 mL用0.1 mol·L-1盐酸进行滴定,得到如下曲线。以下说法或操作正确的是( )
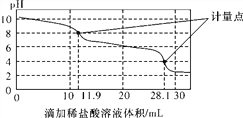
A. 上一个计量点前发生反应的离子方程式为HCO(+H+===H2O+CO2↑
B. 下一个计量点溶液中存在大量的阴离子是Cl-、HCO(
C. 此样品n(NaHCO3)=(28.1-2×11.9)×10-4 mol
D. 使用该方法测定Na2CO3和NaOH混合溶液中的氢氧化钠含量,将会得到1个计量点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
2CO(g) +2NO(g) ![]() N2(g)+2CO2(g) △H1
N2(g)+2CO2(g) △H1
已知:CO的燃烧热△H2=-283kJ/moL
N2(g) +O2(g) =2NO(g)几种化学键的键能数据如下:
化学键 | N≡N键 | O=O键 | NO中氮氢键 |
键能(kJ/mol) | 945 | 498 | 630 |
求△H1__________________。
(2)NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划,在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行下述反应I,测得不同时间的NH3和O2的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
C(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0. 0072 | 0.0072 |
C(O2)/mol·L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述中正确的是______________
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B. 若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.前10分钟内的平均速率v(NO)=0.088mol·L-1·min-1
<>(3)氨催化氧化时会发生下述两个竞争反应I、II。催化剂常具有较强的选择性,即专一性。已知:反应I 4NH3(g)+5O2(g)![]() 4NO(g) +6H2O(g)
4NO(g) +6H2O(g)
反应 II:4NH3(g)+3O2(g) ![]() 2N2(g) +6H2O(g)
2N2(g) +6H2O(g)
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如图:

①该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
② 520℃时,4NH3(g)+3O2![]() 4N2(g) +6H2O(g)的平衡常数K=________________ (不要求得出计算结果,只需列出数字计算式)。
4N2(g) +6H2O(g)的平衡常数K=________________ (不要求得出计算结果,只需列出数字计算式)。
③由图像可判断,反应I正反应△H_______________ 0(填“>”、“<”,或“=”)
④C点比B点所产生的NO的物质的量少的主要原因_________________________。
(4)羟胺(NH2OH)的电子式_____________,羟胺是一种还原剂,可用作显像剂还原溴化银生成银单质和氮气,该反应的化学方程式为______________________________。
现用25.00mL0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL 0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]
G是抗炎症药物的中间体,其合成过程如下:

已知:Ⅰ. Ⅱ.
Ⅱ. (具有较强的还原性)
(具有较强的还原性)
(1)B的结构简式为_________;
(2)反应④的条件为_________;反应①的反应类型为_______;反应②的作用是_________ ;
(3)下列关于G中的描述正确的是___________;
A.具有两性,既能与酸反应也能与碱反应
B.能发生加成、消去、取代和氧化反应
C.能聚合成高分子化合物
D.1molG与足量NaHCO3溶液反应放出2molCO2
(4)D与足量的NaOH溶液反应的化学方程式为_______________________________
(5)符合下列条件的C的同分异构体有_________种
a.属于芳香族化合物,且含有两个甲基 b.能发生银镜反应
c.与FeCl3溶液发生显色反应
其中核磁共振氢谱有4组峰,且峰面积之比为6:2:1:1的是_____________________。
(6)已知:苯环上有烷烃基时,新引入的取代基连在苯环的邻对位;苯环上有羧基时,新引入的取代基连在苯环的间位。依据题意,写出以甲苯为原料合成邻氨基苯甲酸的流程图(无机试剂任选):_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有四种化合物W、X、Y、Z,它们是由短周期元素A、B、C、D、E中的两种元素组成。已知
(1)A、B、C、D、E的原子序数依次增大,且A、D同主族,C、E同主族;B、C 同周期;
(2)W由A、B组成,其分子中原子个数比为A:B=4:1,常温为气态。
(3)X由A、C组成,其分子中原子数比为A:C=1:1
(4)Y是C、D形成的离子化合物,且Y晶体中相应元素的原子个数比为1:1
(5)Z是由D、E形成的离子化合物,其中阳离子比阴离子少一个电子层,阳离子数与阴离子数之比为2:1 则B为__________,W为_________,X的结构式________Y的电子式为______________。
II.(1).一元素原子的N层上只有1个电子,该元素原子各内层均已充满,写出该原子电子排布式:________________,
(2)一元素属于短周期元素,该元素的原子核外所有P轨道全满或者半满,写出该元素原子的价电子轨道排布图__________________,
(3)乙烯分子中有__________个σ键,___________π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016·天津]氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是 (至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式: 。
(2)氢气可用于制备H2O2。已知:
H2(g)+A(l) ![]() B(l) ΔH1
B(l) ΔH1
O2(g)+B(l) ![]() A(l)+H2O2(l) ΔH2
A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g) ![]() H2O2(l)的ΔH 0(填“>”、“<”或“=”)。
H2O2(l)的ΔH 0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是 。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是 。
a.容器内气体压强保持不变
b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为 。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4。同时获得氢气:Fe+2H2O+2OH![]()
![]() +3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色
+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色![]() ,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH)降低的区域在 (填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因为 。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存和发展的重要支柱,化学在能源的开发与利用方面起着十分重要的作用。某学习小组按如下图所示装置探究化学能与电能的相互转化:
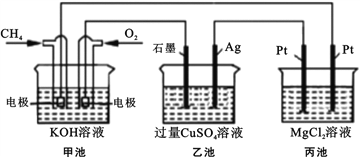
(1) 甲池是_____装置,通入CH4气体的电极上的反应式为_____。乙池中SO42- 移向_____电极(填“石墨”或“Ag”)
(2) 当甲池消耗标况下33.6LO2时,电解质KOH的物质的量变化_____mol,乙池若要恢复电解前的状态则需要加入_____g _____(填物质名称)。
(3) 丙池中发生的电解反应的离子方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com