
| A. | 1molCl2和足量的铁加热条件下反应,转移电子数一定为3NA | |
| B. | 28g乙烯和丙烯的混合物中含有双键数目小于NA | |
| C. | 常温下,PH=13的Ba(OH)2 溶液,0.1L,含OH-,0.02NA | |
| D. | 1 L 1 mol/L的甲醇水溶液中含有氢原子总数为4NA |
分析 A.氯气和铁反应生成氯化铁,电子转移依据反应的氯气计算;
B.28g乙烯物质的量=$\frac{28g}{28g/mol}$=1mol,28g丙烯物质的量$\frac{28g}{42g/mol}$=0.67mol,则28g混合气体含双键数少于1mol;
C.氢氧根离子数目可以以计算物质的量得到;
D.水中也含有氢原子.
解答 解;A.氯气和铁反应生成氯化铁,电子转移依据反应的氯气计算,转移的电子数为2NA,故A错误;
B.若为28g乙烯物质的量=$\frac{28g}{28g/mol}$=1mol,含双键数为1mol,若为28g丙烯物质的量$\frac{28g}{42g/mol}$=0.67mol,双键数小于1mol,则28g乙烯和丙烯的混合物中含有双键数目小于NA,故B正确;
C.0.10L pH=13的Ba(OH)2溶液中OH-的数目=0.1L×0.1mol/L×NA=0.01NA ,故C错误;
D.水中含有氢原子,含有的氢原子总数大于4NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是氧化还原反应电子转移计算、物质结构分析判断、溶液中离子数目减少等,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:选择题
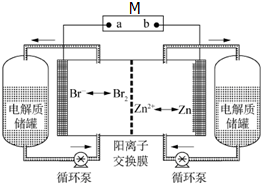 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环流动.左侧电极为惰性电极.放电时M是用电器,充电时M是外电源.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环流动.左侧电极为惰性电极.放电时M是用电器,充电时M是外电源.下列说法不正确的是( )| A. | 锌溴液流电池总反应为:Zn+Br2═ZnBr2 | |
| B. | 放电时右侧电池电极发生氧化反应,电流从a极经用电器流向b极 | |
| C. | 放电时Zn2+从右侧经阳离子交换膜移向左侧,左侧电解质储罐中的离子总浓度增大 | |
| D. | 充电时左侧溴离子浓度下降,左侧电池电极连接电源的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z |
| W | ||
| T |
| A. | Y、W、T元素的原子半径及它们气态氢化物的还原性均依次递增 | |
| B. | Z氢化物的沸点一定比 X氢化物的沸点高 | |
| C. | X、Y元素形成的常见单质的化学键类型相同 | |
| D. | 根据元素周期律,可以推测存在化学式为T2Z3、X3Y4的两种物质,T元素存在同素异形现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
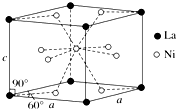 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
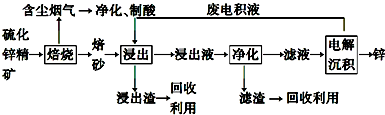
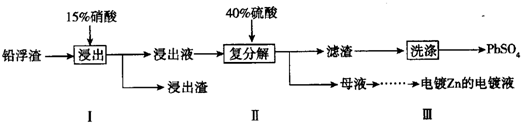
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
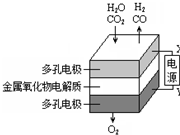 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法正确的是( )| A. | X是电源的正极 | |
| B. | 阳极的反应式是:4OH--4eˉ=2H2O+O2↑ | |
| C. | 总反应可表示为:H2O+CO2=H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com