
【题目】软锰矿主要含有MnO2(约70%)、SiO2、Al2O3,闪锌矿主要含有ZnS(约80%)、FeS、CuS、SiO2。为了高效利用这两种矿石,科研人员开发了综合利用这两种资源的同槽酸浸工艺,主要流程如下图所示,回答下列问题:
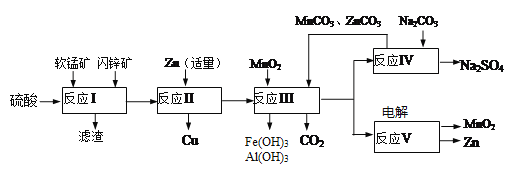
(1)反应Ⅰ所得滤液中含有Mn2+、Zn2+、Cu2+、Fe3+、Al3+等金属阴离子,所得滤液中含有S和______。为了提高硫酸“酸浸”时的浸出速率,可进行的操作是(至少两条):_________。
(2)若反成Ⅱ加入的锌过量,还会进一步发生反应的离子方程式方为_________。
(3)反应Ⅲ中加入MnO2的作用是(离子方程式表示)________;反应Ⅲ中加入MnCO3、ZnCO3的作用是________________。
(4)反应Ⅴ的电解总反应为:MnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4,写出阳极的电极反应式________________。
MnO2+Zn+2H2SO4,写出阳极的电极反应式________________。
(5)MnO2和Zn可按等物质的量之比生产锌-锰干电池,则从生产MnO2和Zn的角度计算,所用软锰矿和闪铲矿的质量比大约是______。(保留小数点后两位)
【答案】 SiO2 提高温度、适量增加硫酸浓度、将矿石粉碎或搅拌或借助鼓风机等 Zn+Fe2+=Zn2++Fe 4H++MnO2+2Fe2+=Mn2++2Fe3++2H2O 调节pH,使Fe3+和Al3+沉淀,且不引入杂质 Mn2+-2e-+2H2O=MnO2+4H+ 1.03
【解析】(1)因为软锰矿主要含有MnO2(约70%)、SiO2、Al2O3,闪锌矿主要含有ZnS(约80%)、FeS、CuS、SiO2,反应Ⅰ中加H2SO4所得滤液中含有Mn2+、Zn2+、Cu2+、Fe3+、Al3+等金属阳离子, SiO2不能和H2SO4反应,所得滤液中含有S和SiO2。为了提高硫酸“酸浸”时的浸出速率,可提高温度、适量增加硫酸浓度、将矿石粉碎或搅拌或借助鼓风机等方法来加快反应速率。答案:SiO2 提高温度、适量增加硫酸浓度、将矿石粉碎或搅拌或借助鼓风机等。
(2)若反成Ⅱ加入的锌过量,还会与Fe2+发生反应,反应的离子方程式方为Zn+Fe2+=Zn2++Fe.
(3)反应Ⅲ中加入的MnO2是氧化剂,可以把Fe2+氧化成Fe3+,离子方程式为4H++MnO2+2Fe2+=Mn2++2Fe3++2H2O;反应Ⅲ中加入的MnCO3、ZnCO3可以和酸反应,所以可用来调节溶液的酸碱性,使Fe3+和Al3+沉淀,且不引入杂质。
(4)反应Ⅴ的电解总反应为:MnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4,阳极发生氧化反应失电子,其电极反应式Mn2+-2e-+2H2O=MnO2+4H+。
MnO2+Zn+2H2SO4,阳极发生氧化反应失电子,其电极反应式Mn2+-2e-+2H2O=MnO2+4H+。
(5))据反应MnSO4+ZnSO4+2H2O=MnO2+Zn+2H2SO4可知MnO2、Zn的物质的量之比为1:1,故可设软锰矿、闪锌矿的质量分别为x、y,得0.7x/87:0.8y/97=1:1,故x:y=1.03.。所用软锰矿和闪铲矿的质量比大约是1.03。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。

回答下列问题:
(1)A中加入的物质是_____________①_____________________________.
发生反应的化学方程式是_______________②_______________________;
(2)B中加入的物质是_____③________,其作用是_________④_______________:
(3)实验时在C中观察到得现象是_____________⑤_________________,
发生反应的化学方程式是_________________⑥____________________;
(4) 实验时在D中观察到得现象是________________⑦__________________,
D中收集到的物质是_______⑧_______,检验该物质的方法和现象是_________⑨_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关各种形态的能量的相互转换途径叙述,错误的是( )
A.家庭液化气灶将化学能转变为热能
B.灯泡将电能全部转变为热能
C.光合作用,将光能转变为化学能
D.太阳能电池将光能转变为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列说法正确的是

A. b点溶液中不可能存在NH3·H2O
B. b、c两点pH相同,但溶液的酸碱性不同
C. 通过降温的方法,可使溶液的状态中d点变为a点
D. a点溶液中可能大量共存的离子:Fe3+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3、和FeO)得到绿矾(FeSO4·7H2O),在通过绿矾制备铁黄[FeO(OH)]的流程如下:
![]()
已知:FeS2和铁黄均难溶于水
下列说法不正确的是
A. 步骤①,最好用硫酸来溶解烧渣
B. 步骤②,涉及的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
C. 步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D. 步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A. 向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B. 向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C. 0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D. 0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 甲苯与足量H2加成产物的一氯取代物有5种
B. ![]() 由3种单体加聚得到
由3种单体加聚得到
C. 双糖、多糖在稀酸的催化下最终均水解为葡萄糖
D. 分子式为C4H6O2并能与饱和NaHCO3溶液反应生成CO2的有机物有3种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2Mg+O2![]() 2MgO的化学反应中:
2MgO的化学反应中:
(1)氧元素的化合价由0价降低为________价,降低了________价;氧气得到电子的总数为________。
(2)镁原子失去电子的总数为________,1 mol Mg反应时转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL0.5mol/L的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如下图所示:
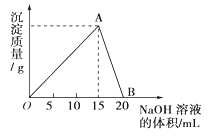
(1)写出AB段发生反应的离子方程式___________。
(2)A点表示的意义是__________。
(3)当所得沉淀量为0.39g时,用去NaOH溶液的体积是_______mL或______mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com