
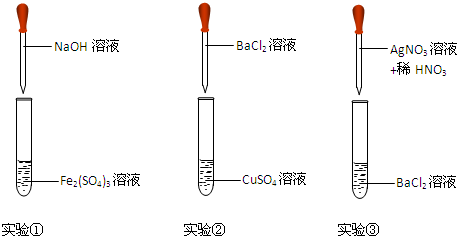
| 编号 | 现象 | 离子方程式 |
| ① | ||
| ② | ||
| ③ |
分析 ①中NaOH与硫酸铁反应生成氢氧化铁和硫酸钠;
②中氯化钡与硫酸铜反应生成硫酸钡和氯化铜;
③中硝酸银与氯化钡反应生成AgCl和硝酸钡,以此来解答.
解答 解:①中NaOH与硫酸铁反应生成氢氧化铁和硫酸钠,观察到有红褐色沉淀生成,发生的离子反应为Fe3++3OH-═Fe(OH)3↓;
②中氯化钡与硫酸铜反应生成硫酸钡和氯化铜,观察到有白色沉淀生成,溶液为蓝色,发生的离子反应为Ba2++SO42-═BaSO4↓;
③中硝酸银与氯化钡反应生成AgCl和硝酸钡,观察到有白色沉淀生成,滴加稀硝酸,沉淀不溶解,发生的离子反应为Ag++Cl-═AgCl↓,
故答案为:
| 编号 | 现象 | 离子方程式 |
| ① | 有红褐色沉淀生成 | Fe3++3OH-═Fe(OH)3↓ |
| ② | 有白色沉淀生成,溶液为蓝色 | Ba2++SO42-═BaSO4↓ |
| ③ | 有白色沉淀生成,滴加稀硝酸,沉淀不溶解 | Ag++Cl-═AgCl↓ |
点评 本题考查物质的性质及反应,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | KClO3、浓盐酸 | Cl2、… |
| A. | 第①组反应的其余产物为H2O和O2 | |
| B. | 第②组反应中Cl2与FeBr2的物质的量之比为1:2 | |
| C. | 第③组反应中还原产物是KCl,生成3 mol Cl2转移电子6mol | |
| D. | 氧化性由强到弱顺序为ClO3->Cl2>Br2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
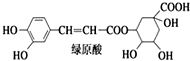
| A. | 分子中可能有 16 个碳原子在同一平面内 | |
| B. | 1 mol 绿原酸与足量溴水反应,最多消耗 4 mol Br2 | |
| C. | 1 mol 绿原酸与足量 NaOH 溶液反应,最多消耗 7 mol NaOH | |
| D. | 绿原酸水解产物均可以与 FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易溶于水的物质一定是电解质 | |
| B. | 有化学键断裂的变化不一定是化学变化 | |
| C. | 溶解于水所得溶液能导电的物质不一定是电解质 | |
| D. | 水受热不易分解,与水分子之间存在的氢键无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
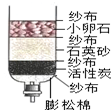
| A. | 该净水器中的活性炭起吸附作用 | B. | 该净水器可以降低自来水的硬度 | ||
| C. | 该净水器能起到杀菌消毒的作用 | D. | 该净水器可将自来水变为蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | 丁 | 反应状况 | |
| 实验一 | 32g | 40g | mg | 9g | 甲与乙恰好完全反应 |
| 实验二 | 16g | 30g | 0.25mol | amol |
| A. | 甲的摩尔质量为32g•mol-1 | |
| B. | 实验二中甲与乙也恰好完全反应 | |
| C. | 若丁的摩尔质量为18g•mol-1,则a=0.5 | |
| D. | 丙的摩尔质量为126g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下,等质量的大理石块和大理石粉与相同浓度的盐酸反应时,粉状的反应速率快 | |
| B. | 将相同大小、相同面积的镁条和铝条与相同浓度的盐酸反应,前者速率大于后者 | |
| C. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 | |
| D. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸和弱酸溶液的酸性 | |
| B. | 纯水在80℃和25℃的pH | |
| C. | 等物质的量的SO2和O2在一定条件下反应,两者的转化率 | |
| D. | 25℃时pH=11的NaOH溶液和pH=11的Na2CO3溶液中的H+的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com