
【题目】“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中的没食子儿茶素(EGC)结构如图所示.关于EGC的下列叙述中正确的是( )
A.EGC的分子式为C15H14O5,属于芳香烃类化合物
B.1molEGC与4molNaOH恰好完全反应
C.该物质能够发生取代反应、加成反应、氧化反应、还原反应、显色反应
D.分子中所有的原子处在同一个平面上
科目:高中化学 来源: 题型:
【题目】我国国标推荐的食品药品中Ca元素含量的测定方法之一:利用Na2C2O4将处理后的样品中的Ca2+沉淀,过滤洗涤,然后将所得CaC2O4固体溶于过量的强酸,最后使用已知浓度的KMnO4溶液通过滴定来测定溶液中Ca2+的含量。针对该实验中的滴定过程,回答以下问题:
(1)KMnO4溶液应该用__(填“酸式”或“碱式”)滴定管盛装,除滴定管外,还需要的玻璃仪器有__。
(2)试写出滴定过程中发生反应的离子方程式:__。
(3)滴定终点的颜色变化:溶液由__色变为__色。
(4)以下哪些操作会导致测定的结果偏高__(填字母编号)。
a.装入KMnO4溶液前未润洗滴定管
b.滴定结束后俯视读数
c.滴定结束后,滴定管尖端悬有一滴溶液
d.滴定过程中,振荡时将待测液洒出
(5)某同学对上述实验方法进行了改进并用于测定某品牌的钙片中的钙元素(主要为CaCO3)含量,其实验过程如下:取2.00g样品加入锥形瓶中,用酸式滴定管向锥形瓶内加入20.00mL浓度为0.10mol·L-1的盐酸(盐酸过量),充分反应一段时间,用酒精灯将锥形瓶内液体加热至沸腾,数分钟后,冷却至室温,加入2~3滴酸碱指示剂,用浓度为0.10mol·L-1的NaOH溶液滴定至终点,消耗NaOH溶液8.00mL。[提示:Ca(OH)2微溶于水,pH较低时不会沉淀]
①为使现象明显、结果准确,滴定过程中的酸碱指示剂应选择__(填“石蕊”、“甲基橙”或“酚酞”)溶液;
②实验过程中将锥形瓶内液体煮沸的目的是___;
③则此2.00g钙片中CaCO3的质量为__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、Q、R,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。由以上某些元素组成的化合物A、B、C、D有如下转化关系:![]() (在水溶液中进行),已知C是溶于水显酸性的气体;D是淡黄色固体。下列叙述错误的是
(在水溶液中进行),已知C是溶于水显酸性的气体;D是淡黄色固体。下列叙述错误的是
A.D的电子式为:![]()
B.X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质的分子式为:C2H2
C.五种元素原子半径由大到小的顺序是:Q>R>Y>Z>X
D.A转化为B的离子方程式一定是:2AlO2-+3H2O+CO2→2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣5molL﹣1 | K1=4.4×10﹣7molL﹣1 K2=5.6×10﹣11molL﹣1 | 3.0×10﹣8molL﹣1 |
请回答下列问题:
(1)同浓度的CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为________。
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)c(OH﹣) D.c(OH-)/ c(H+) E.c(H+)c(CH3COO-)/ c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是________。
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:

则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中由水电离出来的c(H+)________(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是____________________。
(4)已知100℃时,水的离子积为1×10﹣12, 该温度下测得某溶液pH=7,该溶液显________(填“酸”、“碱”或“中”)性.将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a∶b=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+B(g)![]() 2C(g)在固定容积的容器中进行,如果向容器中充入1 mol A和1 mol B,在某温度下达平衡时,C的物质的量分数为m%;若向容器中充入1 mol C,在同样条件下,达到平衡时,C的物质的量分数为n%,则m和n的正确关系是( )
2C(g)在固定容积的容器中进行,如果向容器中充入1 mol A和1 mol B,在某温度下达平衡时,C的物质的量分数为m%;若向容器中充入1 mol C,在同样条件下,达到平衡时,C的物质的量分数为n%,则m和n的正确关系是( )
A.m>nB.m<nC.m=nD.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
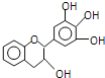
【题目】化合物A(分子式为C6H6O)是一种有机化工原料。A的有关转化反应如下(部分反应条件略去):
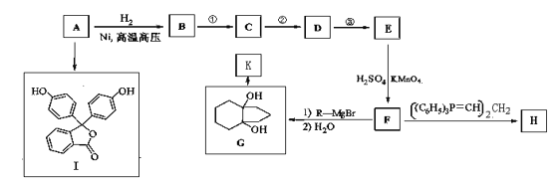
已知:①R-Br![]() R-MgBr
R-MgBr
②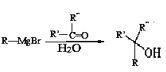
③![]() (R表示烃基或氢原子)
(R表示烃基或氢原子)
(1)写出A的结构简式:____________________________________。
(2)I是常用指示剂酚酞。写出I中含氧官能团的名称:____________和_____________。
(3)符合下列要求的G的同分异构体有________种。
a.G分子中有一个六元环 b.只有两个侧链 c.G能与NaHCO3反应放CO2气体
(4)H和K互为同分异构体。写出反应G→K的化学方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土是一种重要的战略资源。氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:
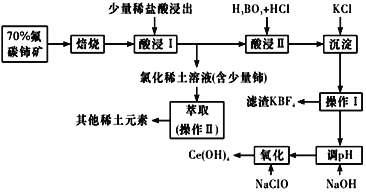
已知:铈的常见化合价为+3、+4。焙烧后铈元素转化成CeO2和CeF4。四价铈不易进入溶液,而三价稀土元素易进入溶液;
酸浸II中发生反应:
9CeO2+3CeF4+45HCl+3H3BO3=Ce(BF4)3↓+11CeCl3+6Cl2↑+27H2O;c(Ce3+)≤10-5 mol/L 时,完全沉淀。
请回答下列问题:
(1)①焙烧时先要将氟碳C矿粉碎,目的是 ___________。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。 少量铈由CeO2进入稀土溶液发生反应的离子方程式是_______。
(3)向Ce(BF4)3中加入KCl溶液的目的是_________。
(4)操作I的名称为_________,在实验室中进行操作II时所需要的硅酸盐仪器有_______。
(5)“操作I”后,向溶液中加入NaOH溶液来调节溶液的pH,以获得Ce(OH)3沉淀,常温下加入NaOH调节溶液的 pH应大于______即可认为Ce3+已完全沉淀。{已知:Ksp[Ce(OH)3]=1.0 ×10-20}
(6)取上述流程中得到的Ce(OH)4产品5.00g,加酸溶解后,向其中加入含0.033 00 mol FeSO4的FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.100 0mol/L的酸性KMnO4标准溶液滴定至终点时,平均消耗20.00 mL标准溶液。则该产品中Ce(OH)4的质量分数为______(保留2位小数,已知氧化性:Ce4+ >KMnO4;Ce(OH)4 的相对分子质量为208)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL 0.1 mol/L的HR溶液中逐滴滴入0.l mol/L 的氨水,溶液pH及导电性变化如图。
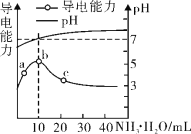
下列分析正确的是
A.HR为强酸
B.加入10 mL 氨水时,溶液中c(NH4+)>c(R-)
C.c点溶液存在c(NH4+)<c( R-)
D.b点的离子浓度大于a点的离子浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能用勒夏特列原理解释的事实是
A.碳酸钙不溶于水,但溶于盐酸
B.由2NO2(g)N2O4(g) 组成的平衡体系,加压后颜色加深
C.工业上选择常压条件合成SO3
D.选择450℃左右的温度合成氨
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com