
【题目】某研究小组欲探究SO2的化学性质,设计了如下实验方案。
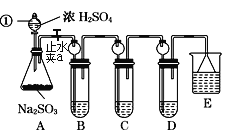
(1)指出仪器①的名称:___。
(2)装置B检验SO2的氧化性,则B中所盛试剂可以为___。
(3)装置C中盛装溴水用以检验SO2的___性,则C中反应的离子方程式为___。
(4)装置D中盛装新制漂白粉浓溶液,通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分提出三种假设:
①假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为___;
假设三:该白色沉淀为上述两种物质的混合物。
②基于假设一,同学们对白色沉淀成分进行了探究。设计如下方案:
限选的试剂:0.5mol·L-1HCl、0.5 mol·L-1H2SO4、0.5mol·L-1BaCl2、1mol·L-1NaOH、品红溶液。
第1步,将D中沉淀过滤、洗涤干净,备用。
请回答洗涤沉淀的方法:___。
第2步,用另一只干净试管取少量沉淀样品,加入___(试剂),塞上带导管的单孔塞,将导管的另一端插入盛有___的试管中。若出现固体完全溶解,出现气泡,且该溶液褪色现象,则假设一成立。
(5)装置E中盛放的试剂是__,作用是___。
【答案】分液漏斗 硫化氢溶液(或硫化钠、硫氢化钠溶液均可) 还原性 SO2+Br2+2H2O=SO42-+4H++2Br- CaSO4 沿玻璃棒向漏斗中加蒸馏水至浸没沉淀,待水流尽重复2到3次以上操作 过量0.5mol·L-1HCl 品红溶液 NaOH溶液 吸收多余的SO2,防止污染环境,造成大气污染
【解析】
探究SO2的化学性质,根据装置图,A装置是制取二氧化硫,装置B检验SO2的氧化性,装置C检验SO2的还原性,装置D探究二氧化硫和漂白粉的反应,装置E为尾气吸收装置。
(4)①新制漂白粉浓溶液中含有的次氯酸根离子具有氧化性,可能氧化亚硫酸根离子;②因沉淀的表面有可溶性的杂质,需用蒸馏水重复洗涤;亚硫酸钙和稀酸能够反应生成二氧化硫,可以借助于二氧化硫具有漂白性检验生成的二氧化硫,据此分析解答。
(1)根据图示,仪器①是分液漏斗,故答案为:分液漏斗;
(2)装置B需要检验SO2的氧化性,硫化氢水溶液或硫化钠、硫氢化钠溶液中的硫元素都为-2价,都能被二氧化硫氧化,体现二氧化硫的氧化性,故答案为:硫化氢水溶液(或硫化钠、硫氢化钠溶液);
(3)在反应Br2+SO2+2H2O═2HBr+H2SO4中,Br元素的化合价由0降低为-1价,则Br2为氧化剂,在反应中表现氧化性,S元素的化合价+4价升高+6价,则SO2为还原剂,在反应中表现还原性,离子方程式为:SO2+Br2+2H2O=SO42-+4H++2Br-,故答案为:还原;SO2+Br2+2H2O=SO42-+4H++2Br-;
(4)①新制漂白粉浓溶液中含有的次氯酸根离子具有强氧化性,二氧化硫具有还原性,会发生氧化还原反应,生成产物可能为硫酸钙,故答案为:CaSO4;
②白色沉淀表面有钙离子和氯离子、硫酸根离子等可溶性的离子,需除去这些离子,方法是沿玻璃棒向漏斗中加蒸馏水至浸没沉淀,待水流尽后重复2~3次以上操作;亚硫酸钙和盐酸反应CaSO3+2HCl═CaCl2+SO2↑+H2O,二氧化硫与品红化合生成无色物质,能使品红溶液褪色;因为出现固体完全溶解,因此不能选用0.5 mol·L-1H2SO4,故答案为:沿玻璃棒向漏斗中加蒸馏水至浸没沉淀,待水流尽后重复2到3次以上操作;过量(或适量)0.5 molL-1HCl;品红溶液;
(5)二氧化硫是有毒气体,属于大气污染物,所以装置E的作用是吸收二氧化硫,防止造成空气污染,可用氢氧化钠,氢氧化钠和二氧化硫反应2NaOH+SO2═Na2SO3+H2O,为防止倒吸,需用倒扣的漏斗,故答案为:NaOH溶液;吸收SO2,防止造成空气污染。


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室欲用固体NaOH配制100 mL 1 mol·L-1的NaOH溶液。
(1)用托盘天平称取NaOH固体的质量为____g
(2)下列情况使所配得溶液的浓度如何变化?(填“偏大”“ 偏小”或“不变”)
A.未洗涤溶解氢氧化钠的烧杯。____
B.容量瓶使用前用蒸馏水洗过,内壁附有水珠而未干燥处理。____
C.定容时加水超过了刻度线,将多出的液体吸出。____
D.定容时俯视容量瓶读数。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个恒容容器中充入N2(g)和H2(g),一定条件下发生反应N2(g)+3H2(g)![]() 2NH3(g),若温度保持不变,下列说法正确的是( )
2NH3(g),若温度保持不变,下列说法正确的是( )
A.容器中的压强始终保持不变
B.反应达到限度后N2(g)和H2(g)的物质的量之比一定为1:3
C.正、逆反应速率相等时各物质质量不再变化
D.当充入足够N2(g)后,H2(g)会全部转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于的说法正确的是
![]()
A. 所有碳原子有可能都在同一平面上
B. 最多可能有9个碳原子在同一平面上
C. 只可能有3个碳原子在同一直线上
D. 有7个碳原子可能在同一条直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有解热镇痛及抗生素作用的药物“芬必得”主要成分的结构简式如图,它属于( )

①芳香族化合物 ②脂肪族化合物 ③有机羧酸 ④有机高分子化合物 ⑤芳香烃
A. ③⑤ B. ②③ C. ①③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种在工业生产中有广泛用途的有机高分子结构片段如图。下列关于该高分子的说法正确的是

A. 能水解成小分子
B. 单体只含有一种官能团
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中M、W、T、L为同一短周期元素,L核外最外层电子数是W核外电子数的一半。下列叙述正确的是
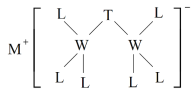
A.化合物ML属于离子化合物,也属于弱电解质
B.该新化合物中T满足8电子稳定结构
C.W的最高价氧化物可以与水反应生成弱酸
D.元素非金属性的顺序为W>T>L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型)。下列关于普伐他汀的性质描述正确的是( )
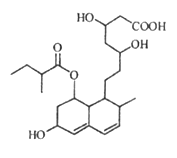
A. 1mol该物质最多可与2molNaOH反应
B. 能发生加成、取代、不能发生消去反应
C. 不能使溴水褪色
D. 能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com