
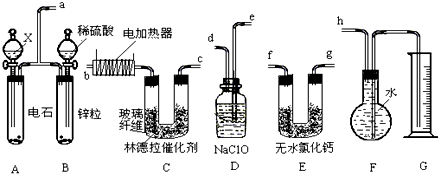
| 林德拉催化剂 |
| 林德拉催化剂 |
| 林德拉催化剂 |
| 1.6(1-18.7%) |
| 65 |
| 0.672L |
| 22.4L/mol |
| 林德拉催化剂 |
| 0.01mol |
| 0.02mol |


科目:高中化学 来源: 题型:
 前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1.由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1.回答下列问题.
前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1.由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D是短周期元素,它们的离子具有相同的电子层结构,且半径依次减小.A与D的化合物X既能与盐酸反应,又能与NaOH溶液反应;B、C组成典型的离子化合物Y,其晶体结构类似于NaCl晶体;A与C以原子个数之比1:1组成化合物Z.
A、B、C、D是短周期元素,它们的离子具有相同的电子层结构,且半径依次减小.A与D的化合物X既能与盐酸反应,又能与NaOH溶液反应;B、C组成典型的离子化合物Y,其晶体结构类似于NaCl晶体;A与C以原子个数之比1:1组成化合物Z.查看答案和解析>>
科目:高中化学 来源: 题型:
| 粒子代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅胶吸附能力强,常用作催化剂载体和食品干燥剂 |
| B、福尔马林可用于保存海鲜产品 |
| C、天然纤维和合成纤维的主要成分都是纤维素 |
| D、工业上利用Cl2与澄清石灰水反应制取漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Na+、NO3-、Cu2+ |
| B、Ba2+、Mg2+、Cl-、SO42- |
| C、Mg2+、K+、OH-、NO3- |
| D、NO3-、SO42-、K+、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3?H2O其c(NH4+)由大到小的顺序是:①>②>③>④ |
| B、某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a |
| C、物质的量浓度相等的H2S、NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)? |
| D、AgCl悬浊液中存在平衡:AgCl(s)?Ag+(aq)+Cl- (aq),往其中加入少量NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com