
| A. | (1+α)n | B. | $\frac{(1+α)n}{1-α}$ | C. | $\frac{(1-α)n}{1+α}$ | D. | (1+2α)n |
分析 设溶液中CH3COO-的物质的量为x,则$\frac{x}{n+x}$=α,求出x,再计算液中的CH3COOH、H+、CH3COO-总物质的量.
解答 解:室温下,某醋酸溶液的电离度为α,电离平衡时溶液中含CH3COOH分子为n mol,
设溶液中CH3COO-的物质的量为x,则$\frac{x}{n+x}$=α,则x=$\frac{an}{1-a}$,溶液中的CH3COOH、H+、CH3COO-总物质的量为$\frac{an}{1-a}$×2+n=$\frac{(1+a)n}{1-a}$mol;
故选B.
点评 本题考查了物质的量的有关计算、电离度的含义,题目难度中等,明确电离度的含义和物质的量的有关计算公式是解题的关键,侧重于考查学生的分析能力和计算能力.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4.0g H218O与D2O的混合物中所含质子数、中子数均为2NA | |
| B. | 常温常压下,0.1mol/L Na2CO3溶液这所含CO32-的数目小于0.1NA | |
| C. | 用惰性电极电解CuSO4溶液,若电路中通过2NA个电子,则阳极产生11.2L气体 | |
| D. | 35℃时,1L pH=2的 H2SO4溶液中所含H+的数目和1L pH=12的NaOH溶液中所含的OH-的数目均为0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(5)(6) | B. | (3)(4)(5) | C. | (2)(3)(5)(6) | D. | (1)(2)(3)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
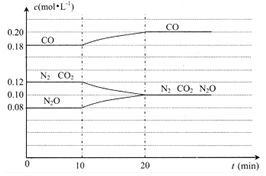 汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应.
汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应.| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(N2O) | n(CO) | n(CO2) | ||
| ① | 400 | 0.20 | 0.30 | 0.14 |
| ② | 500 | 0.10 | 0.40 | 0.080 |
| ③ | 500 | 0.30 | 0.20 | A |
| ④ | 600 | 0.60 | 0.40 | B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子的发现:道尔顿的原子结构模型 | |
| B. | α粒子的散射:汤姆生原子结构模型 | |
| C. | α粒子散射:玻尔原子结构模型 | |
| D. | 氢原子光谱:玻尔原子结构模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的NaN3和Na2O2中所含阴离子数均为NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4g,则电路中转移电子数为0.2NA | |
| C. | 标准状况下,将3.36LCl2通入1L 0.2mol•L-1FeBr2溶液中,被氧化的Br-数目为0.1NA | |
| D. | 标准状况下,11g由${\;}_{1}^{3}$H和${\;}_{8}^{16}$O组成的超重水中,中子数和电子数之和为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mL0.1mol/LCH3COONa溶液与 10mL0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>?c(Cl-)>c(CH3COOH)>?c(H+) | |
| B. | 0.1mol/L Na2C2O4溶液与 0.1mol/L HCl 溶液等体积混合,所得溶液中:2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) | |
| C. | 含等物质的量的NaHC2O4和Na2C2O4的溶液中:2 c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| D. | 将amol/L氨水与0.01mol/L 盐酸等体积混合,若反应完全时溶液中 c(NH4+)=c(Cl-),则NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:选择题
下列说法或表示方法中正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石)==C(石墨);ΔH= -1.9KJ/mol 可知,金刚石比石墨稳定
C.在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=+285.8KJ/mol
D.稀溶液中:H+(aq)+OH—(aq)=H2O(l);ΔH=—53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:填空题
1.00 L 1.00 mol·L-1H2SO4溶液与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ热量,该反应的中和热为____________,表示其中和热的热化学方程式为________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com