
| A. | 11:1 | B. | 9:2 | C. | 1:11 | D. | 2:9 |
分析 某温度下,纯水中c(H+)=10-6mol/L,所以水的离子积常数KW=10-12,pH=8的氢氧化钡溶液中氢氧根离子的物质的量浓度为10-4 mol/L,pH=5的盐酸溶液中氢离子的物质的量浓度为10-5 mol/L,水的离子积常数Kw=10-12,即PH=6时,溶液呈中性,当混合溶液的pH=7时,溶液呈碱性,即氢氧化钡过量,设溶液体积,表示出混合后氢氧根离子浓度,整理可得体积之比.
解答 某温度下,纯水中c(H+)=10-6mol/L,所以水的离子积常数KW=10-12,PH=6时溶液呈中性,当混合溶液的pH=7时,溶液呈碱性,即氢氧化钡过量,混合后溶液中氢氧根离子浓度为$\frac{1{0}^{-12}}{1{0}^{-7}}$mol/L=10-5mol/L,
设盐酸的体积为X L,氢氧化钡的体积为Y L,
两种溶液混合后氢氧根离子的物质的量浓度═$\frac{1{0}^{-4}×Y-1{0}^{-5}×X}{X+Y}$=10-5,解得Y:X=2:9,
故选D.
点评 本题考查了混合溶液PH的计算,难度不大,关键确定水的离子积判断氢氧化钡有剩余.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 钢是用量最大的合金 | |
| B. | 铝锂合金抗腐蚀能力很强,可耐酸碱腐蚀 | |
| C. | 我国在商代就开始使用铜合金 | |
| D. | 铝合金的强度、硬度比纯铝大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
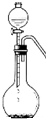 硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下:
硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 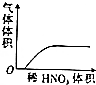 稀HNO3滴入Na2SO3溶液中 | B. | 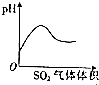 SO2气体通入新制氯水中 | ||
| C. | 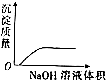 NaOH溶液滴入Ba(HCO3)2溶液中 | D. |  稀H2SO4滴入Ba(OH)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Z、W、Q三种元素的单质属于三种不同的晶体类型 | |
| B. | Q氢化物的熔点高于Z氢化物的熔点 | |
| C. | 一定条件下,Q单质可把Y从其氢化物中置换出来 | |
| D. | 最高价氧化物对应水化物的酸性顺序:Q>Y>W>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含MnO2的分散系中,K+、H2O2、S、Br--可以大量共存 | |
| B. | MnO2和浓盐酸反应的离子方程式:4HCl+MnO2═2Cl-+Cl2↑+Mn2++2H2O | |
| C. | MnO2在高锰酸钾的分解反应中是氧化产物 | |
| D. | 1 mol MnO2和参与反应:3MnO2+4Al═3Mn+2Al2O3,转移4 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2molFe2+被氧化时有1molO2被还原 | B. | 该反应中只有Fe2+是还原剂 | ||
| C. | 每生成1molFe3O4转移2mol电子 | D. | 反应方程式中化学计量数x=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com