
| A、pH=1的溶液中:Na+、Mg2+、SO42-、HCO3- |
| B、含有大量Fe3+的溶液中:.Al3+、Cu2+、Cl-、SO42- |
| C、加入Al能放出H2的溶液中:K+、NH4+、NO3-、Cl- |
| D、使蓝色石蕊试纸变红的溶液:K+、S2-、NO3-、OH- |


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| A、O.lmol过氧化钠中,阴阳离子总数为0.4 NA |
| B、11.2L氯气通入足量的水中充分反应,转移的电子数目为0.5 NA |
| C、42g乙烯与丙烯的混合气体含碳原子数目为3NA |
| D、1L O.lmol/L氨水中,OH-数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 | 起始温度t1/℃ | 终止温 度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
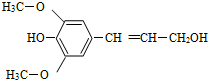 膳食纤维具有的突出保健功能,近年来受到 人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有的突出保健功能,近年来受到 人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )| A、芥子醇的分子式是C11H12O4 |
| B、芥子醇分子中所有碳原子不可能在同一平面 |
| C、1mol芥子醇能与足量溴水反应消耗3molBr2 |
| D、1mol芥子醇与足量的氢气反应消耗氢气4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、维生素C可将 Fe2+还原成为Fe3+ |
| B、亚硝酸盐被氧化 |
| C、亚硝酸盐是氧化剂 |
| D、维生素C是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
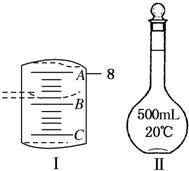 实验室要用CuSO4?5H2O晶体配制500mL 0.1mol/L CuSO4溶液,回答下列问题:
实验室要用CuSO4?5H2O晶体配制500mL 0.1mol/L CuSO4溶液,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
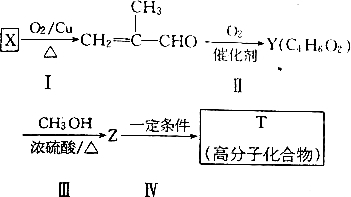
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com