
用惰性电极电解饱和Na2SO4溶液,一段时间后,析出w g Na2SO4·10 H2O晶体,阴极上放出a g气体,则饱和Na2SO4溶液的质量分数为__________。
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
运用电离常数判断可以发生的反应是( )
| 酸 | 电离常数(25 ℃) |
| 碳酸 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| 次溴酸 | Ki=2.4×10-9 |
①HBrO+Na2CO3===NaBrO+NaHCO3
②2HBrO+Na2CO3===2NaBrO+H2O+CO2↑
③HBrO+NaHCO3===NaBrO+H2O+CO2↑
④NaBrO+CO2+H2O===NaHCO3+HBrO
A.①③ B.②④
C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
根据实际和经验推知,下列叙述不正确的是( )
A.卤化氢易溶于水,不易溶于四氯化碳
B.碘易溶于汽油,微溶于水
C.氯化钠易溶于水,也易溶于食用油
D.丁烷易溶于煤油,难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
在特制的密闭真空容器中加入一定量纯净的氨基甲酸铵固体(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)2NH3(g)+CO2(g),已知15 ℃时,平衡气体总浓度为2.4×10-3 mol·L-1。下列说法中正确的是( )
A.密闭容器中气体的平均相对分子质量不变则该反应达到平衡状态
B.15 ℃时氨基甲酸铵的分解平衡常数为2.048×10-9
C.恒温下压缩体积,NH3的体积分数减小
D.再加入一定量氨基甲酸铵,可加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,将E(g)和F(g)充入体积不变的2 L密闭容器中,发生下述反应,并于5 min末达到平衡:2E(g)+F(g)2G(g)。有关数据如下:
| E(g) | F(g) | G(g) | |
| 初始浓度/mol·L-1 | 2.0 | 1.0 | 0 |
| 平衡浓度/mol·L-1 | c1 | c2 | 0.4 |
下列判断正确的是( )
A.反应在前5 min内,v(E)=0.04 mol·L-1·min-1
B.其他条件不变,若增大E的浓度,则达平衡时E的转化率会增大
C.其他条件不变,降低温度,平衡时n(E)=3.0 mol,则反应的ΔH>0
D.平衡后移走2.0 mol E和1.0 mol F,在相同条件下再达平衡时,c(G)<0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
根据2CrO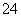 +2H+Cr2O
+2H+Cr2O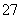 +H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,其电极反应式为________________________________________________________________________。
+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,其电极反应式为________________________________________________________________________。
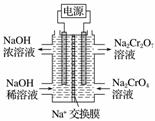
查看答案和解析>>
科目:高中化学 来源: 题型:
电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是________,说明理由:____________________________。
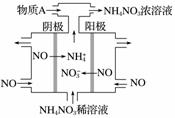
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com