
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
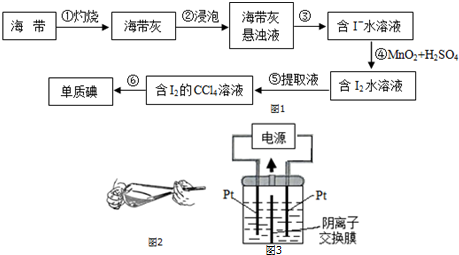
分析 海带灼烧得到海带灰,在水中浸泡溶解过滤得到含碘离子的溶液,加入二氧化锰和硫酸发生氧化还原反应上层碘单质溶液,加入四氯化碳萃取分液得到碘单质的四氯化碳溶液,通过蒸馏得到碘单质,
(1)灼烧海带时,可以从加热仪器、盛放海带的仪器、放置坩埚的仪器判断还缺少的仪器;
(2)分离固体和液体的操作方法为过滤;碘离子在酸性溶液中MnO2具有较强的氧化性,在酸性条件下可氧化碘离子,据此写出反应的离子方程式;
(3)分液漏斗的使用方法为:
a.分液漏斗使用前必须要检漏,要分液漏斗的旋塞芯处和上口的活塞都不漏水才可使用;
b.洗涤时振摇放气,应打开分液漏斗的旋塞,此时分液漏斗下管口应略高于口部;
c.振荡静置完成后,先放出下层液体,然后从上口倒出上层液体;
d.放出下层液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,使内外压强相等,便于液体流下;
(4)碘单质易升华分析;
(5)根据图象判断滴定终点时用去AgNO3溶液的体积;根据硝酸银与碘离子的反应计算出100mL溶液中含有碘离子的物质的量,再计算出500mL溶液中含有的碘离子,最后计算出海带中碘的百分含量;
(6)根据图知电解时,阳极上碘离子失电子发生氧化反应,阴极上得电子发生还原反应,电解反应速率与温度无关,与电流强度、电极之间的距离等有关,据此分析解答.
解答 解:(1)灼烧海带时,需要使用酒精灯加热,海带需要盛放在坩埚中,坩埚放在三脚架上的泥三角上,所以除了三脚架之外,还需要坩埚、泥三角和酒精灯,步骤①灼烧海带时,除三脚架、坩埚、坩埚钳、酒精灯外,还需要用到的实验仪器有泥三角,
故答案为:泥三角;
(2)步骤③是分离固体和液体,则实验操作为过滤,碘离子在酸性条件下可被MnO2氧化,肺炎的离子方程式为:2I-+MnO2+4H+=Mn2++I2+2H2O,
故答案为:过滤:2I-+MnO2+4H+=Mn2++I2+2H2O;
(3)a.分液漏斗使用前必须要检漏,要分液漏斗的旋塞芯处和上口的活塞都不漏水才可使用,故a错误;
b.洗涤时振摇放气,应打开分液漏斗的旋塞,此时分液漏斗下管口应略高于口部,故b正确;
c.静置分层后,先放出下层液体,然后从上口放出上层液体,故c错误;
d.放出下层液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,使内外压强相等,便于液体流下,故d正确;
故答案为:bd;
(4)步骤⑥中若采用蒸馏方法是不合适的,理由是碘易升华,会导致碘的损失,
故答案为:碘易升华,会导致碘的损失;
(5)根据滴定曲线可知,当加入20mL硝酸银溶液时,电动势出现了突变,说明滴定终点时消耗了20.00mL硝酸银溶液;
该小组同学称取a g海带,经过步骤①②③操作得到含I-水溶液b mL,取100.00mL该溶液至滴定池,用0.01000mol•L-1的AgNO3标准溶液滴定,
20.00mL硝酸银溶液中含有硝酸银的物质的量为:0.0100mol/L×0.02L=0.0002mol,则bmL原浸出液完全反应消耗硝酸银的物质的量为:0.0002mol×$\frac{b}{100}$=2.0b×10-6mol,说明ag该海带中含有2.0b×10-6mol碘离子,所以海带中碘的百分含量为:$\frac{2.0b×1{0}^{-6}mol×127g/mol}{ag}$×100%=$\frac{254b×1{0}^{-6}}{a}$×100%,
故答案为:20.00;$\frac{254b×1{0}^{-6}}{a}$;
(6)阳极上碘离子失电子发生氧化反应,电极反应式为I--6e-+6OH-═IO3-+3H2O,电解反应速率与温度无关,与电流强度、电极之间的距离等有关,则保持电流恒定时,升高温度不改变电解反应速率,电解时保持电流恒定,升高温度,电解反应速率将不变,
故答案为:I-+6OH--6e-=IO3-+3H2O;不变.
点评 本题考查物质的分离与提纯方法的综合应用,题目难度较大,试题涉及的知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力,明确实验原理为解答关键,注意熟练掌握化学实验基本操作方法.


科目:高中化学 来源: 题型:选择题

| A. | 该有机物的化学式为:C29H44O | |
| B. | 牛式二烯炔醇能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol牛式二烯炔醇最多可与6molBr2发生加成反应 | |
| D. | 牛式二烯炔醇分子内能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
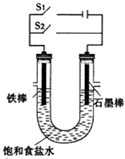 依据电化学反应原理,设计如图所示实验装置.请根据要求回答下列问题.
依据电化学反应原理,设计如图所示实验装置.请根据要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是制备氯丁橡胶的原料,它只比1,3-丁二烯(
)是制备氯丁橡胶的原料,它只比1,3-丁二烯( )多一个氯原子.但由于双键上的氢原子很难发生取代反应,不能通过1,3-丁二烯直接与氯气反应制得.2-氯-1,3-丁二烯的逆合成分析为:
)多一个氯原子.但由于双键上的氢原子很难发生取代反应,不能通过1,3-丁二烯直接与氯气反应制得.2-氯-1,3-丁二烯的逆合成分析为: $\stackrel{①}{→}$
$\stackrel{①}{→}$ $\stackrel{②}{→}$
$\stackrel{②}{→}$ $\stackrel{③}{→}$
$\stackrel{③}{→}$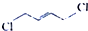 $\stackrel{④}{→}$
$\stackrel{④}{→}$ (提示:可利用1,3-丁二烯与Cl2的1,4-加成反应)
(提示:可利用1,3-丁二烯与Cl2的1,4-加成反应)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应容器中压强不再变化 | |
| B. | X的分解速率与X的生成速率相等 | |
| C. | X、Y、Z的浓度之比为2:1:1 | |
| D. | 单位时间内生成1molY的同时生成1molZ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀硫酸的反应 | |
| B. | 木炭燃烧 | |
| C. | 甲烷在空气中燃烧的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的酸性逐渐增强 | B. | 铜片逐渐溶解 | ||
| C. | 溶液中H+向锌片作定向移动 | D. | 锌片是负极并被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Be(OH)2是两性氢氧化物 | |||||
| B. | 硫粉不溶于水,易溶于CS2中 | |||||
| C. | O3与SO2的结构不相似 | |||||
| D. | 由图知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com