
| A、①和③ | B、只有② |
| C、只有③ | D、①和④ |


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
| A、常温常压下,18g H2O含有2NA个O-H键 |
| B、1L 1mol/L Na2CO3溶液中含有NA个CO32- |
| C、1mol Al被完全氧化生成Al2O3,转移6NA个电子 |
| D、常温下,22.4L的N2和O2混合气体,含有2NA个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯与苯都能使溴水褪色,但褪色原理不同 |
| B、1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol |
| C、溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化反应 |
D、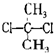 与 与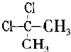 互为同分异构体 互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=2与pH=1的CH3COOH溶液中,c(H+)之比为1:10 |
| B、1.0mol/L的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| C、仅含Na+、H+、OH-、CH3COO-离子的某溶液中可能存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、0.1mol/L的CH3COOH溶液中,由水电离出的c(H+)为1×10-13mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 80 | 100 | 120 |
| K | 1.80 | 2.76 | 3.45 |
| 时间(s) N(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 2.80 | a | 2.00 | c | d | 1.60 |
| n(NO2) | 0 | 0.96 | b | 2.08 | 2.40 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学实验室需要0.2mol/L NaOH溶液500mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
某化学实验室需要0.2mol/L NaOH溶液500mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com