
【题目】对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到:
![]() +H2SO4
+H2SO4![]()
![]() +H2O
+H2O
实验室可利用如图所示装置合成对氨基苯磺酸。实验步骤如下:

①在一个250 mL三颈烧瓶中加入10 mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入18 mL浓硫酸。
②将三颈烧瓶置于油浴中缓慢加热至170~180 ℃,维持此温度2~2.5 h。
③将反应液冷却至约50 ℃后,倒入盛有100 mL冷水的烧杯中,玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品。
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集产品,晾干(100 mL水在20 ℃时可溶解对氨基苯磺酸1.08 g,在100 ℃时可溶解6.67 g)。
(1)装置中冷凝管的作用是____________________。
(2)步骤②中采用油浴加热,用油浴加热的优点是____________________。
(3)步骤③用少量冷水洗涤晶体的好处是____________________。
(4)步骤③和④均进行抽滤,在抽滤后停止抽滤时,应注意先__________________,然后__________________,以防倒吸。
(5)步骤④中有时需要将“粗产品用沸水溶解,冷却结晶,抽滤”的操作进行多次,其目的是____________________________。每次抽滤后均应将母液收集并适当处理,其目的是____________________________。
【答案】 冷凝回流 反应物受热均匀,便于控制温度 减少对氨基苯磺酸的损失 拆下连接泵和吸滤瓶的橡皮管 关闭水龙头 提高对氨基苯磺酸的纯度 提高对氨基苯磺酸的产率
【解析】本题以对氨基苯磺酸的制备为载体考查化学实验操作等。(1)因反应温度较高,为170~180 ℃,会使有机物挥发,故装置中冷凝管的作用是冷凝回流,以提高产率;(2) 采用油浴加热,可以使反应物受热均匀,便于控制温度;(3)因产品的溶解度随温度升高而增大,用冷水洗涤可减少产品的溶解,从而减少损失;(4) 抽滤后停止抽滤时,为了防止发生倒吸,应先拆下连接泵和吸滤瓶的橡皮管,再关闭水龙头;(5)因为产品的溶解度随温度变化的影响较大,故可采用粗产品用沸水溶解,冷却结晶,抽滤的方法对其提纯,此操作多次进行的目的是提高对氨基苯磺酸的纯度,在抽滤后的母液中仍会残留少量产品,应将母液收集集中处理,以回收产品,提高产率。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主要成分为钛酸亚铁(FeTiO3,难溶于水),其中一部分铁元素在风化过程中会转化为+3价。

已知:TiOSO4遇水会水解。
(1)步骤①中,钛酸亚铁与硫酸反应的离子方程式为__________________。
(2)步骤③中,实现混合物的分离是利用物质的___________(填字母序号)。
a. 熔沸点差异 b. 溶解性差异 c. 氧化性、还原性差异
(3)步骤④的操作是_______________(填操作名称)。

(4)步骤④中将TiO2+转化为H2TiO3的原理TiO2++2H2O ![]() H2TiO3+ 2H+,该反应的△H_______0(填>或<);加水稀释,平衡_________(填“正向”、“逆向”或“不”)移动。
H2TiO3+ 2H+,该反应的△H_______0(填>或<);加水稀释,平衡_________(填“正向”、“逆向”或“不”)移动。
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为__________________________。
(6)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。在制备金属钛前后,CaO的总量不变,其原因是(请用化学方程式解释)______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,下列有关该物质的说法正确的是( )

A. 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B. 该分子中的所有碳原子有可能共平面
C. 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4 mol、6 mol
D. 滴入KMnO4酸性溶液,观察到紫色褪去,能证明结构中存在碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医疗上可做抗酸剂。它除了可以中和胃液中多余的酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,缓解刺激。将0.184g三硅酸镁(Mg2Si3O8·nH2O)加入到50 mL0.1 mo1·L-1盐酸中,充分反应后,滤去沉淀,用0.1 mo1· L-1 NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30mL,则n为
A. 6 B. 5 C. 4 D. 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3 , 在一定条件下可实现如图所示的物质之间的变化: 
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是 .
(2)根据上述框图反应关系,写出下列B、E所含物质的化学式 B;E .
(3)写出②、③两个反应方程式 ②;③ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、M、N均为原子序数依次增大的短周期主族元素;R在地壳金属元素中的含量仅次于Z。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4;N-、Z3+、X+离子半径逐渐减小;化合物XN常温下为气体,请回答下列问题:
(1)R在元素周期表中的位置是____________;Z3+的离子结构示意图是____________。
(2)写出X、Y、N按原子个数之比1:1:1:形成的化合物的电子式__________;M和N气态氢化物的稳定性大小比较为________(用化学式和“>”“<”或“=”表示)。
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式__________________________________.
(4)Z元素的单质能与Y和R形成的化合物在一定条件下发生反应,同时放出大量的热,其反应的化学方程式为_____________________________。
(5)下图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,在该转化关系中还原剂是__________(填化学式),示意图中转移电子的数目为______。


(6)由X、Y、M三种元素组成的离子,在水溶液中与H+和OH-均不能大量共存,还能和氯水反应,写出其与新制氯水反应的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为A、B、C、D、E之间的相互转换关系A为一种气态单质,D是一种红棕色气体。下列说法正确的是
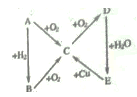
A. C 物质和O2必须在催化剂表面才能反应生成D
B. Cu 和E 溶液反应体现了E 的强氧化性和酸性
C. 可用NaOH 溶液除去混在D物质中的少量B 物质
D. B 生成C 的反应中,氧化剂与还原剂之比为4: 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为FeO和CuO的混合物,取两份等质量的X样品进行下列实验:设第3步所得固体D的质量为 32g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6 L,则X中FeO与CuO的物质的 量之比为( ) 
A.4:1
B.1:2
C.2:1
D.1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com