
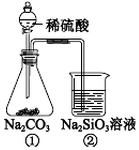
| A. | ①和②中发生的反应均为复分解反应 | |
| B. | 若将实验中的稀硫酸换成稀盐酸也能比较三种酸强弱 | |
| C. | 一段时间后②中有胶冻状物质生成 | |
| D. | 该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸 |
分析 稀硫酸与碳酸钠反应生成二氧化碳气体,证明硫酸的酸性大于碳酸;将生成的二氧化碳气体通入硅酸钠溶液中,会观察到有白色胶状物,反应生成了硅酸胶体,证明了酸性:碳酸>硅酸,以此解答该题.
解答 解:A.①中硫酸与碳酸钠反应生成硫酸钠、二氧化碳气体和水,②中二氧化碳与硅酸钠反应生成硅酸和碳酸钠,两个反应都是复分解反应,故A正确;
B.盐酸易挥发,生成的二氧化碳中混有HCl,不能比较碳酸、硅酸的酸性强弱,故B错误;
C.一段时间后②中生成硅酸胶体,则有胶冻状物质生成,故C正确;
D.稀硫酸与碳酸钠反应生成二氧化碳,证明酸性:硫酸>碳酸;将生成的二氧化碳气体通入硅酸钠溶液中,会观察到有白色胶状物,反应生成了硅酸胶体,证明酸性:碳酸>硅酸,该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸,故D正确;
故选B.
点评 本题考查了比较酸性相对强弱的方法,为高频考点,题目难度中等,明确实验目的、实验原理为解答关键,试题充分考查了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:多选题
| A. | 平衡时N2的转化率:α甲>2α乙 | B. | 平衡时NH3的浓度:2c甲<c乙 | ||
| C. | 平衡时体系压强:2p甲>p乙 | D. | 反应放出的热量:2Q甲>Q乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1735Cl与1737Cl得电子能力相同 | |
| B. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| C. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 | |
| D. | 砹(At)为有色固体,HAt不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
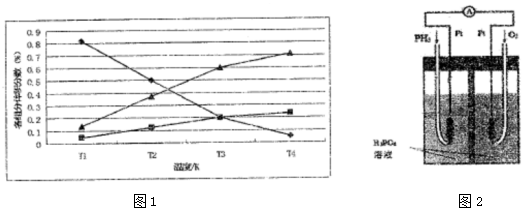
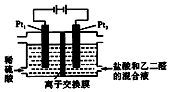 在通电条件下,用如图所示装置由乙二醛(OHC-CHO)反应制备乙二酸(HOOC-COOH).其制备反应为:OHC-CHO+2Cl2+2H2O→HOOC-COOH+4HCl.下列说法正确的是( )
在通电条件下,用如图所示装置由乙二醛(OHC-CHO)反应制备乙二酸(HOOC-COOH).其制备反应为:OHC-CHO+2Cl2+2H2O→HOOC-COOH+4HCl.下列说法正确的是( )| A. | 每消耗0.lmol乙二醛,在Pt1极放出2.24L气体(标准状况) | |
| B. | Pt1的电极反应为:4OH--4e-=2H2O+O2↑ | |
| C. | 每得到1mol乙二酸将有2molH+从右室迁移到左室 | |
| D. | 盐酸是起提供Cl-和增强导电性的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
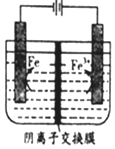
| A. | .阳极主要发生反应:Fe2+-e-═Fe3+ | |
| B. | 可用高纯铁电极作阴扱 | |
| C. | .电解液中的SO42-由右向左通过阴离子交换膜 | |
| D. | .电解法制备髙纯铁总反应:3Fe2+$\frac{\underline{\;通电\;}}{\;}$Fe+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,该分子中含有官能团的名称是羟基、羧基、羰基和碳碳双键,该分子不能发生消去反应(填“能”或者“不能”).二噁英是一类物质的统称,这类物质的母体结构为
,该分子中含有官能团的名称是羟基、羧基、羰基和碳碳双键,该分子不能发生消去反应(填“能”或者“不能”).二噁英是一类物质的统称,这类物质的母体结构为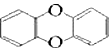 ,其中苯环上的氢原子如果被氯原子取代,所得到的物质毒性是KCN的100倍.该分子中含有官能团的名称是氯原子、醚键.
,其中苯环上的氢原子如果被氯原子取代,所得到的物质毒性是KCN的100倍.该分子中含有官能团的名称是氯原子、醚键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
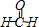 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com