

分析 (1)①根据pKa为电离平衡常数的负对数,即pKa=-lgKa,则pKa越小,电离平衡常数Ka越大;
②0.1mol•L-1KHC2O4溶液中存在:c(C2O42-)>c(H2C2O4),说明HC2O4-的电离程度大于其水解程度;
(2)CaC2O4在水中的沉淀溶解平衡为CaC2O4(s)?Ca2+(aq)+C2O42-(aq),图象中位于曲线上的b、d点为饱和溶液,处于溶解平衡状态,a点处离子浓度小于饱和溶液浓度为不饱和溶液,c点为过饱和溶液,以此解答该题.
解答 解:(1)①由pKa数据可知,4.19<6.37,由pKa=-lgKa,则pKa越小,电离平衡常数Ka越大,则H2CO3的Ka1小于H2C2O4的Ka2,故答案为:小于;
②0.1mol•L-1KHC2O4溶液中存在:c(C2O42-)>c(H2C2O4),说明HC2O4-的电离程度大于其水解程度,溶液显酸性,c(H+) 大于c(OH-),故答案为:大于;
(2)A.在d点c(C2O42-)=1.2×10-4 mol•L-1,因室温时,CaC2O4的溶度积Ksp=2.4×10-9,所以c(Ca2+)=2×10-5 mol•L-1,故x的数值为2×10-5,故A正确;
B.a点处离子浓度小于饱和溶液浓度为不饱和溶液,没有沉淀生成,故B错误;
C.d点为饱和溶液,加入蒸馏水后如仍为饱和溶液,则c(Ca2+)、c(C2O42-)都不变,如为不饱和溶液,则二者浓度都减小,故不可能使溶液由d点变成a点,故C错误;
D.加入适量0.1mol•L-1Na2C2O4溶液,草酸根离子浓度增大,钙离子浓度减小,可使溶液由b点变成d点,故D正确,
故答案为:BC.
点评 本题考查pH的计算、难溶电解质的溶解平衡及沉淀转化等问题,明确pKa的含义是解本题关键,侧重于学生对数据的分析能力的考查,注意分析图象中曲线的变化特点,把握溶度积常数的意义,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 新制氯水放置数天,溶液中的Cl2分子数目不变 | |
| B. | 久置的氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 钠长时间露置于空气中,最终得到Na2CO3粉末 | |
| D. | 钠投入硫酸铜溶液中有红色粉末产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙烯(C6H5CH=CH2)2是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等.工业上以乙苯C6H5CH2CH3为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g)△H
苯乙烯(C6H5CH=CH2)2是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等.工业上以乙苯C6H5CH2CH3为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g)△H查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能使溶液的pH增加 | |
| B. | 都能使溶液的导电性增强 | |
| C. | 溶液中c(H+)•c(OH-)增大 | |
| D. | 都能使溶液中$\frac{c(CHCO{O}^{-})}{c(CHCOO{H}^{+})}$比值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z | Q |
| 反应前质量(g) | 20 | 2 | 1 | 37 |
| 反应后质量(g) | 未测 | 32 | 1 | 12 |
| A. | 物质Z可能是该反应的催化剂 | B. | 反应后物质X的质量为15g | ||
| C. | 反应中Y、Q的质量比为6:5 | D. | 物质Y一定是单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 将②、③混合,若有pH=7,则消耗溶液的体积:②<③ | |
| C. | 将①、④混合,若有c(CH3COO-)>c(H+),则c(OH-)>c(Na+) | |
| D. | 将四份溶液分别稀释100倍后,溶液的pH:③>④,①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. 生成A的化学方程式为
生成A的化学方程式为 +O2$\stackrel{催化剂}{→}$
+O2$\stackrel{催化剂}{→}$ +HCHO.
+HCHO. +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O.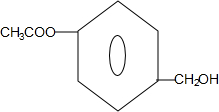 (任写一种结构简式).
(任写一种结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com