
【题目】原子序数依次递增的Q、W、X、Y、Z五种元素中,Q、W、X是分别位于前三个周期且原子最外层电子数之和为10的主族元素,W与Y同主族、X和Y同周期;X是地壳中含量最高的金属元素、Z存在胆矾之中。下列关于它们的叙述合理的是
A. 最高价氧化物对应水化物的酸性比X比Z强
B. W与X简单离子半径后者更大
C. W、Y两种元素最高化合价相同
D. X、Z两种金属在两千多年前就被我们祖先广泛使用
【答案】A
【解析】
原子序数依次递增的Q、W、X、Y、Z五种元素中,X是地壳中含量最高的金属元素,则X为Al;Q、W、X是分别位于前三个周期且原子最外层电子数之和为10的主族元素,则Q为H,W为O;W与Y同主族, X和Y同周期,则Y为S;Z存在胆矾之中,胆矾为CuSO4![]() 5H2O,则Z为Cu,以此分析解答。
5H2O,则Z为Cu,以此分析解答。
综合分析可知,Q为H,W为O,X为Al,Y为S,Z为Cu,
A. X为Al,Z为Cu,Al的最高价氧化物对应水化物为Al(OH)3,Cu的最高价氧化物对应水化物为Cu(OH)2,Al(OH)3属于两性氢氧化物、能和强碱反应,表现酸性,而Cu(OH)2是弱碱,则最高价氧化物对应水化物的酸性:X比Z强,故A正确;
B. W为O,X为Al,离子半径O2->Al3+,故B错误;
C. W为O,Y为S,硫的最高化合价为+6价,而氧元素无最高正价,故C错误;
D. X为Al,由于铝的活泼性很强,发现和使用较晚,故D错误。
故选A。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要成分为Al2O3、SiO2,还含少量Fe2O3等)为原料制取氧化铝的部分工艺流程如下:
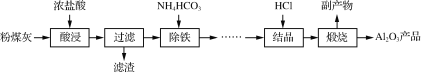
(1)“酸浸”过程发生的主要反应的离子方程式是_______________________________________________。
“酸浸”在恒容密闭反应釜中进行,温度不宜过高的原因是________________________________________________________________________。
(2)“除铁”生成Fe(OH)3的离子方程式为_________________,检验溶液中铁元素已经除尽的方法是________________________________________________________________________。
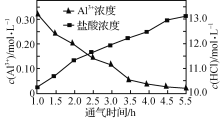
(3)“结晶”是向浓溶液中通入HCl气体,从而获得AlCl3·6H2O晶体的过程,溶液中Al3+和盐酸的浓度随通气时间的变化如下图所示。Al3+浓度减小的原因是_________________________。
(4)上述流程中,可以循环利用的物质是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14%的KNO3溶液与30.0g质量分数为24%的KNO3溶液混合,得到密度为1.15g/cm3的混合溶液。计算:
(1)混合后溶液中KNO3的质量分数为____,物质的量浓度为_____。
(2)在1000g水中需溶解____molKNO3才能使其浓度恰好与上述混合溶液的浓度相等。
(3)标准状况下44.8LHCl溶于水配成500mL溶液。则其浓度为_____,100mL该溶液与足量NaHCO3反应,生成气体在标准状况下为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将标准状况下的a L HCl(g)溶于1000g水中,得到的盐酸密度为b g·cm-3,则该盐酸的物的量浓度是( )mol·L-1
A. 1000ab/(22400+36.5a) B. ab/(22400+36.5a)
C. 1000ab/(22.4+36.5a) D. 1000ab/(22400+36.5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1000mL、密度1.192g·cm3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为_____mol·L1。
(2)该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=____mol·L1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中____L的CO2(标准状况)而变质。(已知:CO2+2NaClO+H2O=Na2CO3+2HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480mL含25%NaClO的消毒液。下列说法正确的是____。
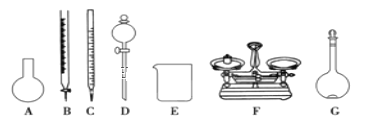
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是两个实验小组分别进行“加热硫酸铜和氢氧化钠溶液反应后生成物”的实验过程示意图
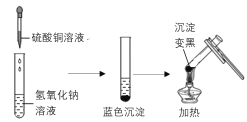
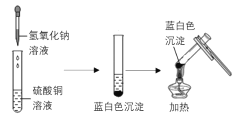
甲组 乙组
(甲组)氢氧化钠与硫酸铜反应的化学方程式为___________,加热后产生黑色的氧化铜。
(乙组)为寻找实验中没有产生氧化铜的原因,他们进行了以下实验探究:
(查阅资料)在酸性条件下,氢氧化钠与硫酸铜在溶液中可发生如下反应:6NaOH+4CuSO4=3Na2SO4+Cu4(OH)6SO4↓,生成的碱式硫酸铜是不溶于水的蓝白色固体,加热不易发生分解。
(提出猜想)根据资料分析,同学们针对试管中溶液呈酸性的原因做出了以下猜想:
猜想Ⅰ:硫酸铜溶液呈酸性 猜想Ⅱ:生成的硫酸钠使溶液呈酸性。
(实验与结论)
实验①:用pH试纸测定硫酸铜溶液的酸碱度,得出其pH______7(填“>”、“<”或“=”),硫酸铜溶液呈酸性,猜想Ⅰ成立。
实验②:向盛有硫酸钠溶液的试管中滴加石蕊溶液,观察到溶液显紫色,硫酸钠溶液呈______(填“酸”、“中”或“碱”)性,猜想Ⅱ不成立。
(交流与反思)(1)乙同学认真分析甲组实验后,一致认为不需要通过实验就能判断猜想Ⅱ不成立,理由是 _________。
(2)在化学反应中,相同的反应物因其质量比不同可能会导致生产物不同,请另举一例______(写出反应物即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应是放热反应,但不是氧化还原反应的是( )
A. 铝片与稀硫酸的反应B. 氢氧化钡与硫酸的反应
C. 灼热的炭与二氧化碳的反应D. 甲烷在氧气中燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有21.6g由CO和CO2组成的混合气体,在标准状况下其体积为13.44L。回答下列问题:

(1)该混合气体的平均摩尔质量为______。
(2)将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下测定)。
①气球中收集到的气体的相对分子质量为______。
②气球中收集到的气体中,电子总数为______(用NA表示阿伏伽德罗常数的值)
③气球的体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol/LNH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发)。下列说法不正确的是
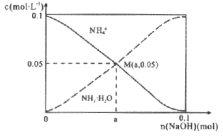
A. M点溶液中水的电离程度比原溶液小
B. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
C. 随着NaOH的加入, 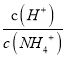 不断增大
不断增大
D. 当n(Na0H)=0.1mol时,c(Na+)=c(NH4+)+c(NH3·H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com