
| A. | 酸式滴定管 | B. | 锥形瓶 | C. | 碱式滴定管 | D. | 以上均不正确 |
分析 滴定管、移液管是用于量取一定体积的溶液的计量仪器,使用前必须洗涤、润洗,特别是洗涤后必须进行润洗,否则会导致待装液浓度减小,影响测定结果;锥形瓶一般用于盛放待测液,用蒸馏水洗涤后不能润洗,否则会导致测定结果偏大.
解答 解:A.滴定管分为酸性和碱式滴定管两种,滴定管在使用前必须用蒸馏水洗涤,然后用待装液润洗,如果用蒸馏水洗涤后立即使用,会导致待装液浓度减小,影响测定结果,故A错误;
B.锥形瓶在滴定过程中用于盛放待测液,用蒸馏水洗涤后不能润洗,避免影响测定结果,所以锥形瓶用蒸馏水洗涤后立即使用,不影响测定结果,故B正确;
C.滴定管分为酸性和碱式滴定管两种,滴定管在使用前必须用蒸馏水洗涤,然后用待装液润洗,如果用蒸馏水洗涤后立即使用,会导致待装液浓度减小,影响测定结果,故C错误;
D.根据以上分析可知,选项B是正确的,故D错误;
故选B.
点评 本题考查了中和滴定中仪器的使用方法判断,题目难度不大,注意掌握中和滴定的操作方法,明确常见仪器的构造及正确的使用方法.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | 同周期X、Y、Z元素的最高价含氧酸的酸性:HXO4>H2YO4>H3ZO4,则气态氢化物还原性HX<H2Y<ZH3 | |
| B. | 元素R的含氧酸的化学式是H2RO3,则其气态氢化物的化学式就是RH4 | |
| C. | 金属与非金属元素分界线附近的元素是过渡元素 | |
| D. | 物质的量相同的Na+、O2-、NH3三种微粒,一定含有相同的质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1盐酸的澄清透明溶液:Fe3+、Na+、SO42-、Br- | |
| B. | pH=1的溶液中:Na+、K+、MnO4-、HCO3- | |
| C. | 能使石蕊变红的溶液:Cu2+、Na+、AlO2-、Cl- | |
| D. | c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是Ca(0H)2在水中的溶解度随温度变化的曲线,下列说法不正确的是( )
如图是Ca(0H)2在水中的溶解度随温度变化的曲线,下列说法不正确的是( )| A. | a点和b点的Ksp:a<b | |
| B. | 向溶液a中加入CaO并恢复原温度时,溶液的pH不变 | |
| C. | b点时,Ca(OH)2在水中和在NaOH溶液中的溶解度:s(H2O)>s(NaOH) | |
| D. | 溶解速率:b点>a点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
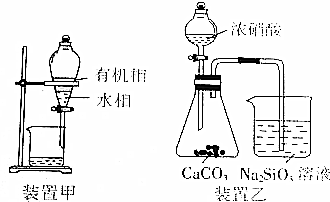
| A. | 制备Fe(OH)3胶体:向0.1mol•L-1FeCl3溶液中加适量NaOH溶液并煮沸片刻 | |
| B. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| C. | 用装置乙进行实验,证明酸性:硝酸>碳酸>硅酸 | |
| D. | 探讨改变浓度研究反应“2Fe3++2I-?2Fe2++I2”中Fe3+和Fe2+的相互转化:向3mL 0.05mol•L-1Fe2(SO4)3溶液中加入3 mL 0.01mol•L-1 KI溶液,将所得黄色溶液等分成三份,第一份加入数滴0.01 mol•L-1AgNO3溶液,第二份加入1mL0.01mol•L-1FeSO4溶液,第三份加1mL水,观察并比较实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应、稀醋酸与稀NaOH溶液反应所测得的中和热都为△H=-57.3kJ/mol | |
| B. | 由C(石墨,s)═C(金刚石,s)△H=+1.9kJ/mol,可知金刚石比石墨稳定 | |
| C. | 在用标准盐酸滴定未知浓度氢氧化钠溶液的实验中,若用待测液润洗锥形瓶,则测定结果偏低(其他操作正确) | |
| D. | 向存在着FeCl3 (黄色)+3KSCN?Fe(SCN)3(血红色)+3KCl平衡体系的溶液中,加少量KCl固体,溶液血红色不发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定前,未用NaOH溶液对锥形瓶进行润洗 | |
| B. | 滴定过程中,有少量盐酸滴在锥形瓶外 | |
| C. | 盛装盐酸前,未对酸式滴定管进行润洗 | |
| D. | 滴定终点时,对酸式滴定管俯视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
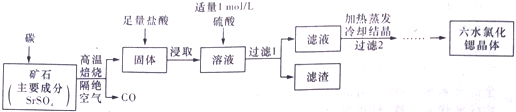
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
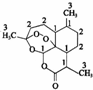 我国药学家屠呦呦教授因发现并提纯青蒿素而获得2015 年诺贝尔奖.青蒿素是用于治疗疟疾的药物,其结构简式如图:下列有关青蒿素的叙述正确的是( )
我国药学家屠呦呦教授因发现并提纯青蒿素而获得2015 年诺贝尔奖.青蒿素是用于治疗疟疾的药物,其结构简式如图:下列有关青蒿素的叙述正确的是( )| A. | 分子式为 C15H2205 | B. | 有较强的还原性,能杀死疟原虫 | ||
| C. | 易溶于水、酒精等溶剂 | D. | 能发生取代反应和加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com