
| A. | 氨水、次氯酸都属于弱电解质 | |
| B. | 有同种元素组成的物质一定是纯净物 | |
| C. | NaHSO4在溶液中能电离出H+,所以NaHSO4是酸 | |
| D. | 侯氏制碱法法的工艺中应用了物质溶解度的差异 |
分析 A.弱电解质是在水溶液中不能完全电离的电解质,包括弱酸、弱碱、水等;
B.有同种元素组成的物质不一定是纯净物,可能为混合物;
C.在水溶液中电离出的阳离子全部是氢离子的化合物叫做酸;
D.侯氏制碱法是将CO2、NH3通入饱和NaCl溶液中,由于NaHCO3溶解度小于Na2CO3,故NaHCO3在溶液中析出.
解答 解:A.氨水是氨气的水溶液,不是电解质,次氯酸是弱酸,属于弱电解质,故A错误;
B.有同种元素组成的物质不一定是纯净物,例如氧气和臭氧都是有氧元素组成,则为混合物,故B错误;
C.NaHSO4在水溶液中电离出H+、Na+、和SO42-,含有酸根离子、金属阳离子和氢离子,属于盐中的酸式盐,故C错误;
D.侯氏制碱法是将CO2、NH3通入饱和NaCl溶液中,发生以下反应:NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NH4Cl+NaHCO3↓,其中NaHCO3溶解度最小,故有NaHCO3的晶体析出,故D正确;
故选D.
点评 本题考查物质的分类、侯氏制碱法的原理等,为高频考点,侧重对基础知识的巩固,题目难度不大,注意基础知识的积累.


科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.9 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 9.7 |
 ,聚乳酸的结构简式为
,聚乳酸的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
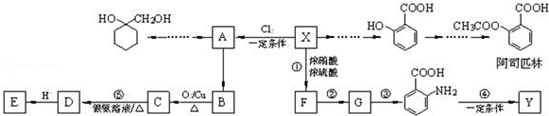
 $\stackrel{MnO(H)}{→}$
$\stackrel{MnO(H)}{→}$
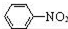 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$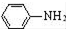 (苯胺,易被氧化)
(苯胺,易被氧化) .
.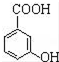 有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式:
有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式: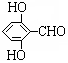 、
、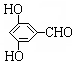 .
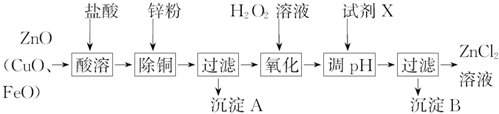
.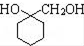 的流程图:
的流程图: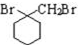 $→_{△}^{NaOH(aq)}$
$→_{△}^{NaOH(aq)}$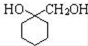
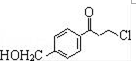
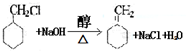 .
.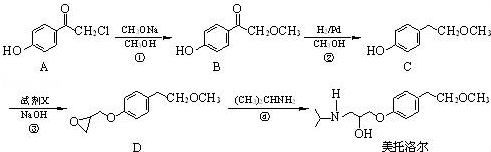
 为原料制备
为原料制备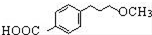 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO的结构式:H-Cl-O | B. | 氨气分子的球棍模型: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 硫化氢分子的电子式: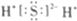 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解池的阳极一定是与电源正极相连,只能选择金属铂或石墨作阳极 | |
| B. | 用惰性材料作电极的电解池装置中,阳离子在阳极放电,阴离子在阴极放电 | |
| C. | 电镀时,电镀糟里的阳极材料发生氧化反应 | |
| D. | 原电池的负极与电解池的阴极都发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
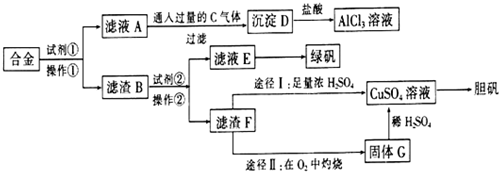
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
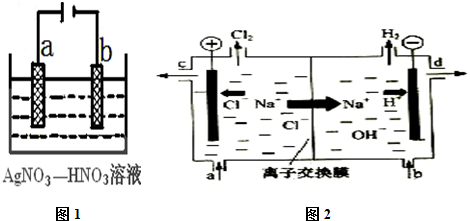
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol/L | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①④⑤ | C. | ①②③ | D. | ②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com