
分析 (1)AlCl3是强酸弱碱盐,Al3+在溶液中会水解;酸能抑制强酸弱碱盐的水解;将AlCl3溶液蒸干、灼烧,AlCl3的水解会被促进;
(2)泡沫灭火器中的药品是NaHCO3和Al2(SO4)3,两者混合发生双水解.
解答 解:(1)AlCl3是强酸弱碱盐,Al3+在溶液中会水解:Al3++3H2O?Al(OH)3+3H+;AlCl3是强酸弱碱盐,水解显酸性,故加入盐酸能能抑制其水解;由于水解生成的HCl是挥发性酸,故将AlCl3溶液蒸干,AlCl3的水解会被促进,完全水解为Al(OH)3,灼烧时Al(OH)3会分解:2Al(OH)3$\frac{\underline{\;加热\;}}{\;}$Al2O3+3H2O,得Al2O3,故答案为:Al3++3H2O?Al(OH)3+3H+;抑制;Al2O3;
(2)泡沫灭火器中的药品是NaHCO3和Al2(SO4)3,两者混合后Al3+和HCO3-发生双水解:Al3++3HCO3-=3Al(OH)3↓+3CO2↑,生成了氢氧化铝和二氧化碳气体,故能灭火.故答案为:Al3++3HCO3-=3Al(OH)3↓+3CO2↑.
点评 本题考查了盐类水解的有关知识,注意影响水解平衡的因素,题目比较基础.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
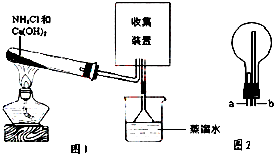 某化学兴趣小组同学用如图所示的实验装置制取氨气并探究氨气的性质,下列有关结论中不正确的是( )
某化学兴趣小组同学用如图所示的实验装置制取氨气并探究氨气的性质,下列有关结论中不正确的是( )| A. | 图1试管中发生反应的化学方程式为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O | |
| B. | 向图1烧杯中滴加酚酞溶液,观察到溶液变红,说明氨水呈碱性 | |
| C. | 用图2装置收集氨气时,进气口是a | |
| D. | 图1中的三角漏斗能起到防止氨气倒吸的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 | |
| B. | 漂白粉长期放置在烧杯中 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 少量的钠保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C2H6的燃烧热为1090 kJ•mol-1,则C2H6燃烧的热化学方程式为:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 25℃,101kPa下,l mol C6H6燃烧生成CO2和液态水时放出3260 kJ热量,其热化学方程式为:C6H6(g)+7.5O2(g)=6CO2(g)+3H2O (l)△H=-3260kJ•mol-1 | |
| C. | 已知常温下:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 | |
| D. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热233kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 碳酸钡与盐酸反应 CO32-+2H+═H2O+CO2↑ | |
| D. | 氢氧化钠溶液与硫酸铜溶液反应 2OH-+Cu2+═Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向铜和稀硫酸的混合物中加入某无色溶液,溶液逐渐变成蓝色,铜逐渐溶解,则该无色溶液一定是硝酸 | |
| B. | 用蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口,有大量白烟,说明该无机酸一定为盐酸 | |
| C. | SO2气体通入Ba(NO3)2溶液中,溶液出现浑浊现象,说明有BaSO3沉淀生成 | |
| D. | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置,下层溶液显紫红色,说明Fe3+的氧化性大于I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com