
【题目】一定温度下,在2L的密闭容器中充入0.4mol SO2和0.2mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0,n(O2)随时间的变化关系如图实线所示:
2SO3(g)△H<0,n(O2)随时间的变化关系如图实线所示:
(1)该温度下反应的平衡常数K为_______________(不用带单位),升高温度K值将_______________(填增大、不变或减小,下同)。
(2)若温度不变,在容器中再加1mol O2,重新达到平衡,则SO2的平衡浓度将_______________,氧气的转化率将_______________,SO3的体积分数将_______________。
(3)仅改变某一实验条件再进行两次实验,测得O2的物质的量随时间变化如图中虚线所示,曲线Ⅰ改变的实验条件是_______________,曲线Ⅱ改变的实验条件是_______________。
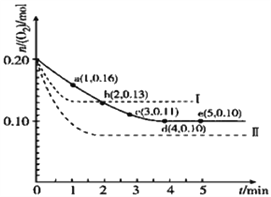
【答案】 20 减小 减小 减小 减小 升高温度 增大压强
【解析】试题分析:(1)由题意和图中实线可知,SO2、O2的起始浓度分别为0.2mol/L、0.1mol/L,O2的平衡浓度分别为0.05mol/L,由2 SO2(g)+O2(g)![]() 2 SO3(g)可知,SO2(g)、O2(g)、SO3(g)的平衡浓度分别为0.1mol/L、0.05mol/L、0.1mol/L,该温度下反应的平衡常数K =
2 SO3(g)可知,SO2(g)、O2(g)、SO3(g)的平衡浓度分别为0.1mol/L、0.05mol/L、0.1mol/L,该温度下反应的平衡常数K =![]() =
=![]() =" 20" Lmol-1;2 SO2(g)+O2(g)
=" 20" Lmol-1;2 SO2(g)+O2(g)![]() 2 SO3(g)的正反应是ΔH < 0的放热反应,升温导致平衡向吸热方向或逆反应方向移动,则平衡常数K减小;(2)若温度不变,在容器中再加1 mol O2,增大氧气浓度,平衡向正反应方向移动,则重新达到平衡,则SO2的平衡浓度将减小;氧气的转化率将减小,虽然其变化浓度增大,但c(O2)起始与c(O2)加入之和增大的程度更大,由
2 SO3(g)的正反应是ΔH < 0的放热反应,升温导致平衡向吸热方向或逆反应方向移动,则平衡常数K减小;(2)若温度不变,在容器中再加1 mol O2,增大氧气浓度,平衡向正反应方向移动,则重新达到平衡,则SO2的平衡浓度将减小;氧气的转化率将减小,虽然其变化浓度增大,但c(O2)起始与c(O2)加入之和增大的程度更大,由![]() 可知,氧气的平衡转化率降低;原平衡时,SO3的体积分数=
可知,氧气的平衡转化率降低;原平衡时,SO3的体积分数=![]() =40%;若温度不变,在容器中再加1 mol O2,平衡右移,设氧气的变化浓度为xmol/L,重新达到平衡时,SO2(g)、O2(g)、SO3(g)的平衡浓度分别为(0.1-2x)mol/L、(0.65-x)mol/L、(0.1+2x)mol/L,SO3的体积分数=
=40%;若温度不变,在容器中再加1 mol O2,平衡右移,设氧气的变化浓度为xmol/L,重新达到平衡时,SO2(g)、O2(g)、SO3(g)的平衡浓度分别为(0.1-2x)mol/L、(0.65-x)mol/L、(0.1+2x)mol/L,SO3的体积分数=![]() ,由于正反应不能进行到底,则SO3的体积分数介于
,由于正反应不能进行到底,则SO3的体积分数介于![]() =11.8%和
=11.8%和![]() =25%之间,则SO3的体积分数比原平衡时减小;(3)从实线到虚线中的曲线I,达到平衡的时间缩短且氧气的平衡浓度增大,说明平衡向逆反应方向移动且反应速率加快,由于2 SO2(g)+O2(g)
=25%之间,则SO3的体积分数比原平衡时减小;(3)从实线到虚线中的曲线I,达到平衡的时间缩短且氧气的平衡浓度增大,说明平衡向逆反应方向移动且反应速率加快,由于2 SO2(g)+O2(g)![]() 2 SO3(g)的正反应是ΔH < 0的放热反应,因此采取的措施是升高温度;从实线到虚线中的曲线II,达到平衡的时间缩短且氧气的平衡浓度减小,说明平衡向正反应方向移动且反应速率加快,由于2 SO2(g)+O2(g)
2 SO3(g)的正反应是ΔH < 0的放热反应,因此采取的措施是升高温度;从实线到虚线中的曲线II,达到平衡的时间缩短且氧气的平衡浓度减小,说明平衡向正反应方向移动且反应速率加快,由于2 SO2(g)+O2(g)![]() 2 SO3(g)的正反应是气体体积减小的方向,因此采取的措施是增大压强或缩小容器的容积。
2 SO3(g)的正反应是气体体积减小的方向,因此采取的措施是增大压强或缩小容器的容积。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】2012年中国汽车销量大幅增长,同时也带来了严重的空气污染.汽车尾气装置中,气体在催化剂表面吸附与解吸的过程如图所示,下列说法正确的是( ) 
A.反应中NO为氧化剂,N2为氧化产物
B.汽车尾气的主要污染成分包括CO、NO和N2
C.NO和O2必须在催化剂表面才能反应
D.催化转化总反应为2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上,用器承取滴露。”这里所用的“法”是指
A. 萃取 B. 过滤 C. 蒸馏 D. 干馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a mol Na和amol Al一同投入m g足量水中,所得溶液密度为dg·㎝-3,该溶液的质量分数为
A.82a /(46a + m)%B.82000a /(46a + 2m)%
C.8200a /(46a + m)%D.8200a /(69a +2 m)%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境、工农业生产等密切相关,下列叙述正确的是( )
A.光化学烟雾与大量排放碳氢化合物和氮氧化合物有关
B.将草木灰和硫酸铵混合施用,肥效更高
C.棉花的主要成分是纤维素,石英玻璃、陶瓷和水泥均属于硅酸盐产品
D.硫酸工业尾气未经处理就直接排放,将直接导致“温室效应”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2作为氧化剂在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题:
(1)定性分析:图甲可通过观察_______________________________________定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是_____________________________。
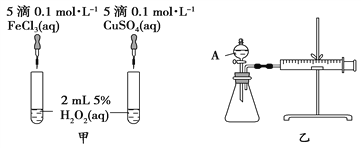
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是:关闭A的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看__________________________,实验中需要测量的数据是____________________________________________________。
(3)课本在研究浓度对反应速率影响的实验中,酸性高锰酸钾和弱酸草酸反应的离子方程式为____________________________________________________,反应开始一段时间后反应速率明显提升的原因是_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2.5 mol A和2.5 mol B混合盛入容积为2 L的密闭容器里,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol· (L·s)-1,同时生成1 mol D,下列叙述中错误的是( )
xC(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol· (L·s)-1,同时生成1 mol D,下列叙述中错误的是( )
A. 达到平衡状态时A的转化率为50%
B. x=4
C. 达到平衡状态时容器内气体的压强与起始时压强比为6∶5
D. 5 s内B的反应速率v(B)=0.05 mol · (L·s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:2CH3OH+3O2=2CO2+4H2O。下列说法中正确的是 ( )

A. 左边的电极为电池的负极,a处通入的是甲醇
B. 右边的电极为电池的负极,b处通入的是空气
C. 电池负极的反应式为:CH3OH+H2O+6e-=CO2+6H+
D. 电池的正极反应式为:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下按如图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol·L-1的硫酸溶液,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0 ℃、101 kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是( )
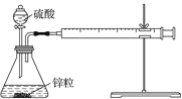
A. 可以通过测定锌粒减少质量来测定反应速率
B. 忽略锥形瓶内溶液体积的变化,用H+来表示10 s内该反应的速率为0.01 mol·L-1·s-1
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内该反应速率为0.01 mol·L-1·s-1
D. 用H2来表示10 s内该反应的速率为0. 000 2 mol·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com