
【题目】亚氯酸钠![]() 是重要漂白剂.探究小组开展如下实验,回答下列问题:
是重要漂白剂.探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取![]() 晶体按如图装置进行制取。
晶体按如图装置进行制取。

已知:![]() 饱和溶液在低于
饱和溶液在低于![]() 时析出
时析出![]() ,高于
,高于![]() 时析出
时析出![]() ,高于
,高于![]() 时
时![]() 分解成
分解成![]() 和NaCl.
和NaCl.
(1)用![]() 双氧水配制
双氧水配制![]() 的
的![]() 溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要______
溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要______![]() 填仪器名称
填仪器名称![]() ;
;
(2)装置C的作用是______;
(3)装置B内生成的![]() 气体与装置D中混合溶液反应生成
气体与装置D中混合溶液反应生成![]() ,生成
,生成![]() 的反应方程式为______.
的反应方程式为______.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是______;
(5)反应后,经以下步骤可从装置D的溶液获得![]() 晶体.请补充完整操作iii.
晶体.请补充完整操作iii.
![]() 蒸发结晶;
蒸发结晶;![]() 趁热过滤;iii.______;
趁热过滤;iii.______;![]() 低于
低于![]() 干燥,得到成品.
干燥,得到成品.
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的![]() 晶体中含少量
晶体中含少量![]() 。产生
。产生![]() 最可能的原因是______;
最可能的原因是______;
![]() 中有
中有![]() 气体产生,并有部分进入D装置内
气体产生,并有部分进入D装置内
![]() 中浓硫酸挥发进入D中与NaOH中和
中浓硫酸挥发进入D中与NaOH中和
![]() 中的硫酸钠进入到D装置内
中的硫酸钠进入到D装置内
(7)测定样品中![]() 的纯度。测定时进行如下实验:
的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:![]() ,将所得混合液稀释成100mL待测溶液。
,将所得混合液稀释成100mL待测溶液。
取![]() 待测溶液,加入淀粉溶液做指示剂,用c
待测溶液,加入淀粉溶液做指示剂,用c![]()
![]() 标准液滴定至终点,测得消耗标准溶液体积的平均值为V
标准液滴定至终点,测得消耗标准溶液体积的平均值为V![]() 已知:
已知:![]()
![]() 确认滴定终点的现象是______;
确认滴定终点的现象是______;
![]() 所称取的样品中
所称取的样品中![]() 的物质的量为______
的物质的量为______![]() 用含c、V的代数式表示
用含c、V的代数式表示![]() 。
。
【答案】量筒 防止D瓶溶液倒吸到B瓶中![]() 或安全瓶
或安全瓶![]()
![]()
![]() 和NaCl 用
和NaCl 用![]() 左右的热水洗涤3遍
左右的热水洗涤3遍![]() 热水温度高于
热水温度高于![]() ,低于
,低于![]() a 滴加最后一滴
a 滴加最后一滴![]() 标准液时,溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点
标准液时,溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点 ![]()
【解析】
装置B中制备得到![]() ,所以B中反应为
,所以B中反应为![]() 和
和![]() 在浓
在浓![]() 的作用生成
的作用生成![]() 和
和![]() ,装置C为安全瓶,装置D反应后的溶液获得
,装置C为安全瓶,装置D反应后的溶液获得![]() 晶体,装置D中生成
晶体,装置D中生成![]() ,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,装置E为吸收多余的气体,防止污染空气,装置A是吸收B中剩余气体,
,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,装置E为吸收多余的气体,防止污染空气,装置A是吸收B中剩余气体,
![]() 用
用![]() 双氧水配制
双氧水配制![]() 的
的![]() 溶液是计算、量取、溶解、转移、洗涤、定容、摇匀等步骤选择仪器;
溶液是计算、量取、溶解、转移、洗涤、定容、摇匀等步骤选择仪器;
![]() 装置C的作用是安全瓶,有防倒吸作用,装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;
装置C的作用是安全瓶,有防倒吸作用,装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;
![]() 装置B中制备得到
装置B中制备得到![]() ,所以B中反应为
,所以B中反应为![]() 和
和![]() 在浓
在浓![]() 的作用生成
的作用生成![]() 和
和![]() ,二氧化氯和氢氧化钠反应生成
,二氧化氯和氢氧化钠反应生成![]() ;
;
![]() 由题目信息可知,应控制温度
由题目信息可知,应控制温度![]() ,高于
,高于![]() 时
时![]() 分解成
分解成![]() 和NaCl;
和NaCl;
![]() 从装置D的溶液获得
从装置D的溶液获得![]() 晶体,需要蒸发结晶、趁热过滤、洗涤、干燥;
晶体,需要蒸发结晶、趁热过滤、洗涤、干燥;
![]() 中可能发生
中可能发生![]() 浓
浓![]() ,产生的
,产生的![]() 被带入D中,
被带入D中,![]() 与
与![]() 反应生成硫酸钠;
反应生成硫酸钠;
![]() 碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴
碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴![]() 标准液时溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点;
标准液时溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点;
![]() 根据化学反应可得关系式:
根据化学反应可得关系式:![]() ,根据关系式计算。
,根据关系式计算。
![]() 用
用![]() 双氧水配制
双氧水配制![]() 的
的![]() 溶液,需要的仪器有量筒、烧杯、玻璃棒、胶体滴管,所以还需要量筒,
溶液,需要的仪器有量筒、烧杯、玻璃棒、胶体滴管,所以还需要量筒,
故答案为:量筒;
![]() 装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中,
装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中,
故答案为:防止D瓶溶液倒吸到B瓶中![]() 或安全瓶
或安全瓶![]() ;
;
![]() 装置B中制备得到
装置B中制备得到![]() ,所以B中反应为
,所以B中反应为![]() 和
和![]() 在浓
在浓![]() 的作用生成
的作用生成![]() 和
和![]() ,反应的方程式为
,反应的方程式为![]() ,二氧化氯和双氧水、氢氧化钠反应生成
,二氧化氯和双氧水、氢氧化钠反应生成![]() ,反应方程式为
,反应方程式为![]() ,
,
故答案为:![]() ;
;
![]() 由题目信息可知,应控制温度
由题目信息可知,应控制温度![]() ,高于
,高于![]() 时
时![]() 分解成
分解成![]() 和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是
和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是![]() 和NaCl,
和NaCl,
故答案为:![]() 和NaCl;
和NaCl;
![]() 从装置D的溶液获得
从装置D的溶液获得![]() 晶体,需要蒸发结晶、趁热过滤、洗涤、干燥操作,所以第iii步操作是用
晶体,需要蒸发结晶、趁热过滤、洗涤、干燥操作,所以第iii步操作是用![]() 左右的热水洗涤3遍
左右的热水洗涤3遍![]() 热水温度高于
热水温度高于![]() ,低于
,低于![]() ,故答案为:用
,故答案为:用![]() 左右的热水洗涤3遍
左右的热水洗涤3遍![]() 热水温度高于
热水温度高于![]() ,低于
,低于![]() ;
;
![]() 中可能发生
中可能发生![]() 浓
浓![]() ,产生的
,产生的![]() 被带入D中,
被带入D中,![]() 与
与![]() 反应生成硫酸钠,浓硫酸难挥发,硫酸钠是难挥发的盐,不会进入D,故a正确,b、c错误,故选:a,
反应生成硫酸钠,浓硫酸难挥发,硫酸钠是难挥发的盐,不会进入D,故a正确,b、c错误,故选:a,
故答案为:a;
![]() 碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴
碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴![]() 标准液时溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点,
标准液时溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点,
故答案为:滴加最后一滴![]() 标准液时,溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点;
标准液时,溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点;
![]() 根据
根据![]() , 在25mL溶液中,n(NaClO2)=
, 在25mL溶液中,n(NaClO2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×
× ![]() =
=![]() ×
×![]() 。所以所取样品中n(NaClO2)=
。所以所取样品中n(NaClO2)=![]() ×
×![]() ×
×![]() =
=![]() 。
。
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】亚硝酸钠是重要的防腐剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如图装置,利用一氧化氮与过氧化钠反应制备亚硝酸钠(夹持装置和A中加热装置已略,气密性已检验)。
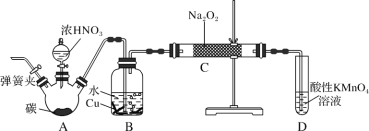
查阅资料:
①HNO2为弱酸,室温下存在反应:3HNO2=HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成;
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
实验操作:
①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
(1)B中观察到的主要现象是_______,D装置的作用是_______。
(2)经检验C产物中亚硝酸钠含量较少。甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。生成碳酸钠的化学方程式是_______。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是_______ (写名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究硫酸亚铁的分解产物,将已加热至恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
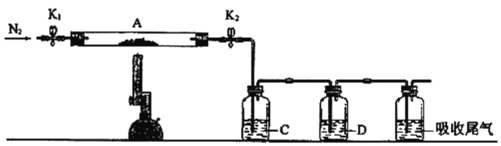
①C、D中的溶液依次为___、___(填标号)。C、D中有气泡冒出,并可观察到的现象分别为___。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的转化关系,回答下列问题:

(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率可用于衡量电解质溶液导电能力的大小。向10mL 0.3 mol·L-1Ba(OH)2溶液滴入0.3 mol·L-1 NH4HSO4溶液,其电导率随滴入的NH4HSO4溶液体积的变化如图所示(忽略BaSO4溶解产生的离子)。下列说法不正确的是
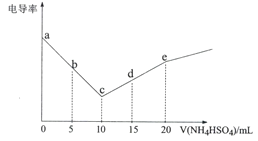
A.a→e的过程水的电离程度逐渐增大
B.b点:c(Ba2+) =0.1 moI.L-1
C.c点:c(NH4+)<c(OH-)
D.d点:c(SO42-)+c(H+)>c(OH-)+c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L1盐酸与50 mL 0.55 mol·L1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
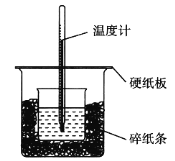
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________________。
(2)烧杯间填满碎纸条的作用是______________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填”偏大”“偏小”或”无影响”)。
(4)实验中改用60 mL 0.50 mol·L1盐酸跟50 mL 0.55 mol·L1 NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填”相等”或”不相等”),所求中和热__________(填”相等”或”不相等”),简述理由:_________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会__________(填”偏大”“偏小”或”无影响”,下同);用50 mL 0.50 mol·L1 NaOH溶液进行上述实验,测得的中和热的数值会__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界上绝大部分卤素都存在于海洋。海水晒盐可以得到粗盐和卤水,对粗盐和卤水进一步加工可以得到氯气、溴以及其他一些重要的化工产品。完成下列填空:
(1)工业上用电解饱和食盐水的方法获取氯气。写出电解饱和食盐水的离子方程式_______。若转移 5mol 电子,生成氯气_______L(标准状况下)。
溴主要以 Br-形式存在于海水中,海水呈弱碱性。工业上制备的 Br2 的操作步骤为:
①一定条件下,将 Cl2 通入浓缩的海水中,生成 Br2
②利用热空气将 Br2 吹出,并用浓 Na2CO3 溶液吸收,生成 NaBr、NaBrO3、CO2
③用硫酸酸化步骤②得到的混合物
(2)先在卤水中加入硫酸酸化,然后再通入氯气,硫酸酸化可以提高氯气的利用率,原因是 _______。
(3)写出步骤②化学方程式 _______。
(4)写出步骤③所发生的化学反应方程式并标出电子转移的方向和数目_______。
(5)用上述方法制得的液溴常溶有少量氯气,除去氯气的方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质投入溶液中,溶液质量减轻的是( )
A.CaCO3投入到HCl溶液中
B.Na2CO3投入稀硫酸中
C.Fe粉投入CuSO4溶液中
D.Fe粉投入稀HCl溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
A. 稀释溶液,水解平衡常数增大
B. Ksp(CuS)<Ksp[Cu(OH)2]
C. 升高温度![]() 增大
增大
D. 加入MgCl2固体,HS-浓度减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com