
一定条件下反应mA(g)+nB(g)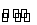 pC(g)+qD(g)在一密闭容器中进行,测得平均反应速率v(C)=2v(B)。若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是( )
pC(g)+qD(g)在一密闭容器中进行,测得平均反应速率v(C)=2v(B)。若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是( )
A.2、6、3、5 B.3、1、2、1
C. 3、1、2、2 D.1、3、2、2
科目:高中化学 来源: 题型:
实验室用下列仪器,以乙醇、浓硫酸和溴为原料制备1,2二溴乙烷。已知1,2二溴乙烷熔点为9 ℃,C2H5OH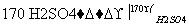 CH2===CH2↑+H2O。
CH2===CH2↑+H2O。
2C2H5OH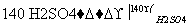 C2H5—O—C2H5+H2O
C2H5—O—C2H5+H2O
(乙醚)
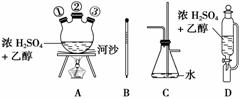

(1)如果气体流向为从左到右,正确的连接顺序是(短接口或橡皮管均已略去):B经A①插入A中,D接A②;A③接________接________接________接________。
(2)装置A中反应器的名称为________,仪器D的名称为________,河沙的作用为________。
(3)写出仪器C的两个作用:________________________________________________。
(4)温度计水银球的正确位置是_________________________________________________。
(5)反应管E中加入少量水及把反应管E置于盛有冷水的小烧杯中是因为________________________________________________________________________。
(6)若产物中有少量未反应的Br2,最好用________(填正确选项前的字母)洗涤除去。
a.饱和亚硫酸氢钠溶液
b.氢氧化钠溶液
c.碘化钠溶液
d.乙醇
(7)产品中可能会有的有机杂质是______,可用________方法除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
B.化学反应速率为0.8 mol·L-1·s-1是1 s时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象就越明显
查看答案和解析>>
科目:高中化学 来源: 题型:
某恒温密闭容器发生可逆反应Z(?)+W(?) X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是( )
X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是( )
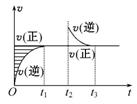
A.Z和W在该条件下一定不为气态
B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度相等
D.若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:
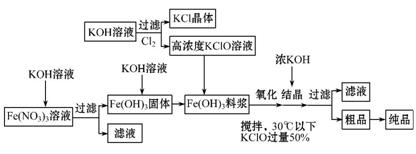
(1)上述氧化过程中,发生反应的离子方程式是 ,
控制反应温度30℃以下的原因是 。
(2)结晶过程中加入浓KOH溶液的作用是 。
(3)已知常温下Ksp[Fe(OH)3]=1.25×10-36,则Fe(NO3)3溶液中加入KOH溶液到
pH= 时,Fe3+才能完全沉淀(当溶液中某种离子浓度小于10-5mol·L-1时可看作完全沉淀,lg2=0.3,lg5=0.7),常温下反应Fe3++3H2O Fe(OH)3+3H+的平衡常数K= [水解生成的Fe(OH)3为胶体,其浓度不代入计算式,写出计算结果]。
Fe(OH)3+3H+的平衡常数K= [水解生成的Fe(OH)3为胶体,其浓度不代入计算式,写出计算结果]。
(4)最近,工业上用表面附有铁的氧化物的铁丝网作阳极,电解KOH溶液制备K2FeO4,优点是原料价廉,效率高。若用一表面附有Fe3O4的铁丝网20.0 g作阳极电解,当电路中通过1.4 mol电子时,铁丝网恰好电解完全。此时生成K2FeO4的质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
B.用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度
C.邻苯二甲酸氢钾可用于标定NaOH溶液的浓度。假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小
D.向某溶液中加入茚三酮试剂,加热煮沸后溶液若出现蓝色,则可判断该溶液含有蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
制备Fe(OH)3胶体,下列操作方法能使之成功的是( )
A.把Fe2O3粉末放在水中加热至沸
B.氯化铁溶液中加少量氨水
C.把约30 mL蒸馏水加热至沸,滴入几滴浓氯化铁溶液
D.在约30 mL蒸馏水中加数滴氯化铁浓溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com