
| A. | 2.24 L CO2中含有的原子数为0.3×6.02×1023 | |
| B. | 0.1 mol F- 中含有的电子数等于0.9×6.02×1023 | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| D. | 电解饱和食盐水若产生2 g氢气,则转移的电子数目为2×6.02×1023 |
分析 A.气体摩尔体积vm=22.4L/mol的使用条件是标准状况(0℃、101kPa);
B.F原子得到一个电子变成F-,F-中含有的电子数是10;
C.硝酸是强氧化剂将铁氧化成铁离子;
D.依据电解饱和食盐水中的阴极电极反应计算转移电子数.
解答 解:A.2.24L CO2中含有的原子数,状况不知,无法求物质的量,使用条件是标准状况(0℃、101kPa),故A错误;
B.F-中含有的电子数是10,所以0.1mol F-中含有的电子数等于1×6.02×1023,故B错误;
C.硝酸是强氧化剂,硝酸足量时,将铁氧化成铁离子,5.6g铁为0.1mol,失去的电子数一定为0.3×6.02×1023,硝酸不足时,可能一部分转化为亚铁,或铁过量,转移电子远小于0.3×6.02×1023,选项中一定就错了,故C错误;
D.电解饱和食盐水若产生2g氢气,物质的量为1mol,2H++2e-=H2↑,则转移的电子数目为2×6.02×1023,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,注意气体摩尔体积的使用范围和条件.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:解答题
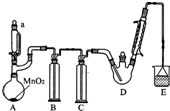 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 7 | 9 |
| n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
| A. | 其他条件不变,向平衡体系中再充入0.32mol A,再达平衡时,B的转化率增大 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前v (逆)>v (正) | |
| C. | 其他条件不变,起始时向容器中充入各0.64mol A和B,平衡时n(C)<0.48mol | |
| D. | 反应前2 min的平均速率v(C)=0.004 mol•(L•min)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 9种 | C. | 13种 | D. | 15种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl=NH4++Cl- | B. | NaHSO4=Na++HSO42- | ||
| C. | H2CO3=2H++CO32- | D. | CH3COOH→CH3++COOH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
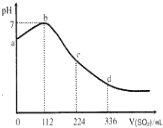
| A. | b 点对应的溶液导电性最强 | |
| B. | 亚硫酸是比氧硫酸更弱的酸 | |
| C. | 原H2S溶液的物质的量浓度为0.05mol•L-1 | |
| D. | ab段反应是:SO2+2H2S═3S↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
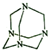
| A. | 分子式为N4C6 | B. | 分子中的氮原子全部是sp2杂化 | ||
| C. | 分子中共形成4个六元环 | D. | 分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅的原子结构示意图: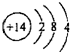 | |
| B. | 乙烯分子比例模型: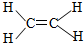 | |
| C. | 二氧化碳分子的电子式: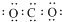 | |
| D. | 硫酸铁的电离方程式:Fe2(SO4)3═2Fe2++3SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com