
 两份质量相等且组成完全相同的镁铝合金,一份投入足量的稀硫酸中,另一份投入足量的氢氧化钠溶液,生成氢气在标准状况下的体积与反应时间的关系如图.
两份质量相等且组成完全相同的镁铝合金,一份投入足量的稀硫酸中,另一份投入足量的氢氧化钠溶液,生成氢气在标准状况下的体积与反应时间的关系如图.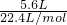 =0.25mol,根据电子转移守恒可知金属失去的电子的物质的量为0.25mol×2=0.5mol,
=0.25mol,根据电子转移守恒可知金属失去的电子的物质的量为0.25mol×2=0.5mol,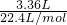 =0.15mol,根据电子转移守恒可知n(Al)=
=0.15mol,根据电子转移守恒可知n(Al)=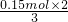 =0.1mol.一份镁铝合金与足量稀硫酸反应时失去电子总物质的量为0.5mol,故n(Mg)=
=0.1mol.一份镁铝合金与足量稀硫酸反应时失去电子总物质的量为0.5mol,故n(Mg)=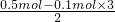 =0.1mol,故合金中中镁铝的物质的量之比为0.1mol:0.1mol=1:1,
=0.1mol,故合金中中镁铝的物质的量之比为0.1mol:0.1mol=1:1,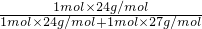 ×100%=47.1%
×100%=47.1% 计算氢气的物质的量,根据电子转移守恒计算金属失去的电子的物质的量;
计算氢气的物质的量,根据电子转移守恒计算金属失去的电子的物质的量; 计算氢气的物质的量,根据电子转移守恒计算n(Al),再结合(1)中与硫酸反应金属提供的电子物质的量计算n(Mg),据此计算;
计算氢气的物质的量,根据电子转移守恒计算n(Al),再结合(1)中与硫酸反应金属提供的电子物质的量计算n(Mg),据此计算;

科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
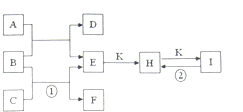 如图是常见的一些单质及其化合物之间的转化关系图.常温常压下,D、F、K均为无色无刺激性气味的气体,C为活泼的金属单质,B是最常见的无色液体,A是有单质C在D中燃烧生成的淡黄色固体,I是焙制糕点所用的发酵粉的主要成分之一.(反应中生成的部分物质已略去)
如图是常见的一些单质及其化合物之间的转化关系图.常温常压下,D、F、K均为无色无刺激性气味的气体,C为活泼的金属单质,B是最常见的无色液体,A是有单质C在D中燃烧生成的淡黄色固体,I是焙制糕点所用的发酵粉的主要成分之一.(反应中生成的部分物质已略去)查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 O2(g)△H2=242kJ?mol-1
O2(g)△H2=242kJ?mol-1 O2(g)=MgO(s)△H3=-602kJ?mol-1
O2(g)=MgO(s)△H3=-602kJ?mol-1
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com