
科目:高中化学 来源:广东北江中学2007高三第二轮定量实验专题练习、化学 题型:058
| |||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
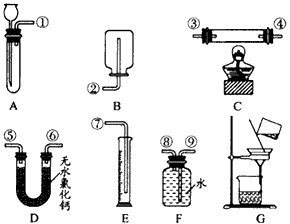
某学生要用50 mL NaOH溶液和CO2来制取纯Na2CO3溶液,已知CO2气体在通入NaOH溶液过程中极易生成NaHCO3,且无明显现象。
实验室有下列试剂:①未知浓度的NaOH溶液 ②37%的盐酸 ③37%的硫酸 ④14%的盐酸 ⑤大理石⑥饱和NaHCO3溶液
实验室有下列仪器:量筒,烧杯,橡皮管,玻璃导管,分液漏斗,烧杯,洗气瓶,酒精灯。
已知下表中各物质在常温时的溶解度(g/100 g H2O)
| Na2CO3 | NaHCO3 | NaCl | Na2SO4 | NaHSO4 | NaOH |
| 15.9 | 8.4 | 35 | 35.5 | 20 | 40 |
本实验除了下面图给的仪器外,还应有: (仪器安装补完整)。
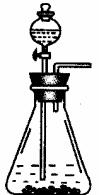
实验为保证制得Na2CO3的纯度,应选用的药品,除①外,还应需要: 。
简要叙述实验步骤,直到制得纯碳酸钠溶液 。
根据给出的溶解度表,若保证在配制过程中不会有晶体析出,所用氢氧化钠溶液中含NaOH的质量分数的最大值是多少(写出计算步骤和必要的文字说明)?
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生要用50 mL NaOH溶液和CO2来制取纯Na2CO3溶液,已知CO2气体在通入NaOH溶液过程中极易生成NaHCO3,且无明显现象。
实验室有下列试剂:①未知浓度的NaOH溶液 ②37%的盐酸 ③37%的硫酸 ④14%的盐酸 ⑤大理石⑥饱和NaHCO3溶液
实验室有下列仪器:量筒,烧杯,橡皮管,玻璃导管,分液漏斗,烧杯,洗气瓶,酒精灯。
已知下表中各物质在常温时的溶解度(g/100 g H2O)
| Na2CO3 | NaHCO3 | NaCl | Na2SO4 | NaHSO4 | NaOH |
| 15.9 | 8.4 | 35 | 35.5 | 20 | 40 |
本实验除了下面图给的仪器外,还应有: (仪器安装补完整)。
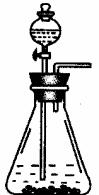
实验为保证制得Na2CO3的纯度,应选用的药品,除①外,还应需要: 。
简要叙述实验步骤,直到制得纯碳酸钠溶液 。
根据给出的溶解度表,若保证在配制过程中不会有晶体析出,所用氢氧化钠溶液中含NaOH的质量分数的最大值是多少(写出计算步骤和必要的文字说明)?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com