

分析 (1)根据铜的还原性和硝酸的氧化性,写出化学反应方程式,根据方程式书写离子反应方程式;
(2)①由题意可知,这种成分不能与稀硝酸反应,而Fe、Al均与硝酸反应;
②反应生成的NO被空气中的氧气氧化为二氧化氮;
(3)①为了证明产生的气体是NO,则该实验装置要防止产生的气体与空气接触,漏斗的作用是防止稀硝酸溢出;
②关闭活塞,产生的气体使稀硝酸液面下降,从而使铜丝与稀硝酸分开,反应停止;
(4)NO能与空气中的氧气反应,故不能用排空气法来收集NO,只能用排水法,C和D装置符合题意,E装置是洗气装置.
解答 解:(1)硝酸具有氧化性,能氧化金属,铜和硝酸反应,铜从0价变为+2价,变成硝酸铜,硝酸中的+5价的氮被还原成一氧化氮,反应的化学方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑;
(2)①由题意可知,这种成分不能与稀硝酸反应,而Fe、Al均与硝酸反应,所以ABC不行,DE不与硝酸反应,
故答案为:CD;
②反应生成的NO被空气中的氧气氧化为二氧化氮,呈红棕色,发生反应为2NO+O2=2NO2,
故答案为:2NO+O2=2NO2;
(3)①为了证明产生的气体是NO,则该实验装置要防止产生的气体与空气接触,漏斗的作用是接收被气体压出U形管的液体,防止稀硝酸溢出,
故答案为:接收被气体压出U形管的液体,防止稀硝酸溢出;
②关闭活塞,产生的气体使稀硝酸液面下降,从而使铜丝与稀硝酸分开,反应停止,
故答案为:关闭U形管右端导气管上的活塞,反应产生的气体将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止;
(4)NO能与空气中的氧气反应,故不能用排空气法来收集NO,只能用排水法,C和D装置符合题意,E装置是洗气装置,故答案为:C、D;
点评 本题考查性质实验方案的设计,为高频考点,把握物质的性质、实验装置的作用、性质实验分析是解题关键,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. |  点燃酒精灯 | B. |  称取氯化钠 | C. |  液体加热 | D. |  量取9.5mL的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
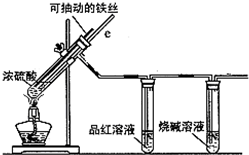 某校化学小组为探究铁与浓硫酸反应是否生成SO2,设计了以下装置进行实验.
某校化学小组为探究铁与浓硫酸反应是否生成SO2,设计了以下装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| NO的物质的量(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
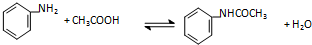
| 物质 | 相对分子质量 | 熔点(℃) | 沸点 | 溶解度(g) | |
| 水 | 乙醇 | ||||
| 苯胺 | 93 | -6 | 184 | 3.42(20℃) | 任意比混溶 |
| 乙酸 | 60 | 17 | 117.9 | 任意比混溶 | 任意比混溶 |
| 乙酰苯胺 | 135 | 114 | 304 | 0.56(20℃) 3.45(50℃) 5.20(100℃) | 36.9(20℃) |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com