
����Ŀ����ҵ����ƽ�VOSO4�е�K2SO4��SiO2���ʳ�ȥ�����յõ�V2O5���������£�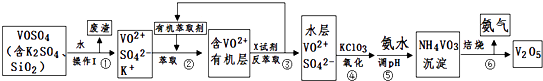
��ش��������⣺
��1����������÷����ijɷ�����д��ѧʽ��������I������ ��
��2������ڡ��۵ı仯���̿ɼ�Ϊ����ʽR��ʾVO2+ �� HA��ʾ�л���ȡ������R2��SO4��n ��ˮ�㣩+2nHA���л��㣩2RAn���л��㣩+nH2SO4 ��ˮ�㣩
������ȡʱ��������������ԭ���� ��
����X�Լ�Ϊ ��
��3���ܵ����ӷ���ʽΪ ��
��4��25��ʱ��ȡ����������������õ��������ʺ���ҺpH֮���ϵ���±���
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
��������% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
����ϱ�����ʵ�������У����м��백ˮ��������Һ�����pHΪ �� ����������Ϊ93.1%ʱ������Fe��OH��3����������Һ��c��Fe3+���� �� ����֪��25��ʱ��Ksp[Fe��OH��3]=2.6��10��39��
��5���ù��������У�����ѭ�����õ��������� ��
���𰸡�
��1��SiO2������
��2��������кͲ������ᣬƽ����������˷�����ȡ�ʣ�����
��3��ClO3��+6VO2++9H2O=Cl��+6VO3��+18H+
��4��1.7��1.8��2.6��10��3mol?L��1
��5���л���ȡ��������
���������⣺VOSO4�к���K2SO4��SiO2���ʣ��������費����ˮ����ˮ�ܹ��˵õ�����VO2����SO42����K+��Һ������Ϊ�������裬����Һ�м����л���ȡ����ȡ��Һ��VO2�� �� ͨ����Һ�õ�����VO2�����л��㣬�����Լ�X���з���ȡ����ϣ�2���в���ڡ��۵ı仯Ϊ������̣���֪XΪ���ᣬ���������Һ�õ��л����ˮ�㣬�ɼ��백ˮ����pH�õ��ij�������֪����������KClO3����VO2��ΪVO3�� �� ��ϣ�4���еõ��������ʺ���ҺpH֮���ϵ����֪pHӦ������1.7��1.8�����NH4VO3�ֽ�õ�������V2O5 �� �ɹ������̿�֪���������л��ܼ�����ѭ�����ã���1������K2SO4��SiO2���ʵ�VOSO4ˮ�ܺ������費����ˮ������I�Ƿ��뻥�����ܵĹ�����Һ̬��Ӧ��ȡ���˲������õ�����Ϊ�������裬���Դ��ǣ�SiO2�����ˣ���2��������ȡʱ��������������Rn+��ˮ�㣩+nHA���л��㣩RAn���л��㣩+nH+��ˮ�㣩����֪����ļ���ƽ���е������ӷ�Ӧ���ٽ�ƽ��������У�����˷�����ȡ�ʣ����з���ȡʱ�����X�Լ�������ƽ��������У����Լ�����������ƽ��������У����Դ��ǣ�������кͲ������ᣬƽ����������˷�����ȡ�ʣ������3��KClO3����VO2��ΪVO3�� �� ClO3������ԭΪCl�� �� ��ƽ�����ӷ���ʽΪ��ClO3��+6VO2++9H2O=Cl��+6VO3��+18H+ �� ���Դ��ǣ�ClO3��+6VO2++9H2O=Cl��+6VO3��+18H+����4�����ݱ��������жϣ����м��백ˮ��������ҺpH���ֵΪ1.7��1.8����ʱ�������ʴﵽ�������������Ϊ93.1%ʱ������Fe��OH��3��������ʱpH=2��c��H+��=10��2mol/L����c��OH����=10��12mol/L����Ksp[Fe��OH��3]=c��Fe3+����c3��OH����=2.6��10��39 �� �ɵ�c��Fe3+��=2.6��10��3molL��1������Fe��OH��3����������Һ��c��Fe3+����2.6��10��3molL��1 �� ���Դ��ǣ�1.7��1.8��2.6��10��3molL��1����5���ɹ�ҵ����ͼ��֪���������л���ȡ������������ѭ�����ã����Դ��ǣ��л���ȡ����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����Ȼ�ѧ����ʽ�У���ѧ��Ӧ�ġ�Hǰ�ߴ��ں��ߵ��ǣ� ��
��C��s��+O2��g��=CO2��g����H1��C��s��+ ![]() O2��g��=CO��g����H2
O2��g��=CO��g����H2
��S��s��+O2��g��=SO2��g����H3��S��g��+O2��g��=SO2��g����H4
��H2��g��+ ![]() O2��g��=H2O��l����H5��2H2��g��+O2��g��=2H2O��l����H6
O2��g��=H2O��l����H5��2H2��g��+O2��g��=2H2O��l����H6
��CaCO3��s��=CaO��s��+CO2��g����H7��CaO��s��+H2O��l��=Ca��OH��2��s����H8 ��
A.�ڢۢ�
B.��
C.��
D.�٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪CO2������ϳ��Ҵ��ķ�Ӧԭ��Ϊ��2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ��H =-173.6 kJ/mol
C2H5OH(g)+3H2O(g) ��H =-173.6 kJ/mol
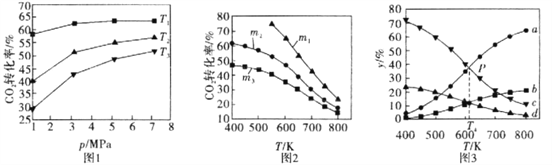
��1��ͼl��ͼ2�ֱ���CO2��ƽ��ת������ѹǿ���¶ȵı仯��ϵ����֪mΪ��ʼʱ��Ͷ�ϱȣ���m=![]() ��
��
��ͼl��Ͷ�ϱ���ͬ���¶ȴӸߵ��͵�˳��Ϊ________��
��ͼ2�У�m1��m2��m3Ͷ�ϱȴӴ�С��˳��Ϊ________��������________��
��2��ͼ3��ʾ����ѹΪ5MPa�ĺ�ѹ�����£���m=3ʱ����ͬ�¶��¸����ʵ����ʵ����������¶ȵĹ�ϵ��
������b����������Ϊ________���ѧʽ����
��ͼ3��P��ʱ��CO2��ת����Ϊ________��
��T4�¶�ʱ���÷�Ӧ��ƽ�ⳣ��Kp=________������ʾ����ƽ���ѹ����ƽ��Ũ�������㣬ij���ƽ���ѹ=��ѹ������ֵ����ʵ����������������С�������λ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����λ��ѧ������ϩ�����ֽⷴӦ�о��еĽܳ������ٻ�2005���ŵ������ѧ����ϩ�����ֽⷴӦ��ʾ����ͼ�� ![]()
���л������У�����ϩ�����ֽⷴӦ��������  ���ǣ� ��
���ǣ� ��
A.
B.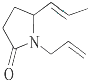
C.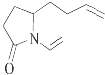
D.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʼ��仯�����й㷺Ӧ�ã�
��1���������ƣ��㷺���ڶ�����������Ӽ���Ŀǰ���Ʊ����¹��շ����У�ʯ�ҷ�����ʯ��ʯ�к����ᣬ�����յ�pHΪ3.2���ȵ��������ƣ���д���÷�Ӧ�Ļ�ѧ����ʽ������1��103kgʯ��ʯ���������kg�������ƣ�
��2����ʯӢ����̿����ʯ[��Ҫ�ɷ�Ca5��PO4��3F]�ڸ������Ʊ����ף�P4���Ļ�ѧ����ʽΪ��4Ca5��PO4��3F+21SiO2+30C=3P4+20CaSiO3+30CO��+SiF4�����ڴ˷�Ӧ�У���������������� ��
��3�������������Ϊ����������ӣ�����ṹ��ʽ��ͼ ![]() ��֮����ȥ����ˮ���ӵIJ����ṹ��ʽΪ �� ���������ƣ��׳ơ����ơ����dz��õ�ˮ���������仯ѧʽΪ ��
��֮����ȥ����ˮ���ӵIJ����ṹ��ʽΪ �� ���������ƣ��׳ơ����ơ����dz��õ�ˮ���������仯ѧʽΪ ��
��4���������ƣ�NaH2PO2�������ڻ�ѧ��������ѧ��������Һ�к���Ni2+��H2PO2�� �� �����������·���������Ӧ������ƽ�÷�Ӧ���ӷ���ʽNi2++H2PO2��+�TNi++H2PO3��+ ��
��5��H3PO2���õ��������Ʊ��������ҵ�������������ԭ����ͼ��ʾ����Ĥ����Ĥ�ֱ�ֻ���������ӡ�������ͨ��������д�������ĵ缫��Ӧʽ ��
�ڷ�����Ʒ�ҿɵõ�H3PO2��ԭ �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ͭпԭ��ص�װ��ʾ��ͼ���ش��������⣺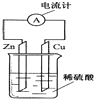
��1��ԭ����ǽ���ת�����ܵ�װ�ã�
��2���ڵ����е��������ķ���������������Ϊ �� �������ܹ۲쵽�������� ��
��3��ԭ����ܲ��������ı���ԭ������ѡ���ţ���a�������������Բ�ͬ�ĵ缫 b���������ƶ�������
c��������������ԭ��Ӧ d���γ��˱պϻ�·��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��R֪ij�¶ȵ���ƽ�ⳣ��ΪK�����¶�����20mL 0.1mol/L CH3COOH��Һ����μ���01mol/L NaOH��Һ����pH�仯������ͼ��ʾ�������¶ȱ仯��������˵������ȷ���ǣ� �� 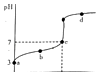
A.a���ʾ��Һ��c��CH3COO��������Ϊ10��3 mol/L
B.b���ʾ����Һ��c��Na+����c��CH3COO����
C.c���ʾCH3COOH��NaOHǡ�÷�Ӧ��ȫ
D.d���ʾ����Һ�� ![]() ����K
����K
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֤�������д��ڵ�Ԫ�ص�ʵ������У���Ҫ����ѡ�ô�����ǣ� ��
ѡ�� | ���� | ��Ҫ���� |
A | ��ȡ3.0g�ɺ��� | ������ƽ |
B | ���ոɺ�������ȫ��ɻҽ� | ������ |
C | ������к�ĺ�������ˮ�Ļ��Һ | ©�� |
D | �����Ȼ�̼��������ĺ����ҽ�ȡҺ����ȡ�� | ��Һ©�� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ǿ������ʴ�ԣ�����Ǧ����Ϊ���Դ����Al��������Pb�����������ϡ���ᣬʹ�����������Ĥ�����䷴Ӧԭ�����£���أ�Pb��s��+PbO2��s��+2H2SO4��aq��=2PbSO4��s��+2H2O��l�������أ�2Al+3H2O ![]() Al2O3+3H2�����������У������ж���ȷ���ǣ� ��
Al2O3+3H2�����������У������ж���ȷ���ǣ� ��
��� | ���� | |
A | H+����Pb�缫 | H+����Pb�缫 |
B | ÿ����3molPb | ����2molAl2O3 |
C | ������PbO2+4H++2e��=Pb2++2H2O | ������2Al+3H2O��6e��=Al2O3+6H+ |
D |
|
|
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com