
| A. | Fe3+、Br-、Al3+、H+、CO32-、H2PO4-这些离子都能破坏水的电离平衡 | |
| B. | 常温下,往饱和石灰水中加入一定量的生石灰,一段时间后恢复到原温度,溶液的pH变小 | |
| C. | CuSO4、K2CO3、KMnO4的水溶液分别在空气中小心加热蒸干至质量不再减少为止,都能得到较纯净的原溶质 | |
| D. | Na2C2O4溶液中存在:c(OH-)=c(H+)+c(H2C2O4) |
分析 A、凡是可以和水电离的离子结合的弱离子都会影响水的电离平衡;
B、生石灰与水反应生成氢氧化钙,此过程中饱和溶液中溶剂的质量减小,故会有溶质析出,由于温度不变,故此饱和溶液的溶度积不变,即氢氧根的浓度不变;
C、加热蒸干至质量不再减少为止,能得到较纯净的原溶质,需要依据溶液中 溶质的水解、分解、氧化等反应,结合生成产物的性质分析判断;
D、根据溶液中的质子守恒进行判断即可.
解答 解:A、Fe3+、Br-、Al3+、H+、CO32-、H2PO4-这些离子都对水的电离平衡起到一定的影响,能破坏水的电离平衡,故A正确;
B、生石灰与水反应生成氢氧化钙,此过程中饱和溶液中溶剂的质量减小,故会有溶质析出,此时温度不变,氢氧化钙的溶度积常数不变,故氢氧根浓度不变,pH不变,故B错误;
C、CuSO4、K2CO3的水溶液分别在空气中小心加热蒸干至质量不再减少为止,都能得到较纯净的原溶质,但是高锰酸钾受热易分解,加热蒸干得到的是分解产物,故C错误;
D、Na2C2O4溶液中存在质子守恒:c(OH-)=c(H+)+2c(H2C2O4)+c(HC2O4-),故D错误.
故选A.
点评 本题综合考查学生盐的水解原理以及应用、溶液中三大守恒的书写是重点,注意知识的迁移应用是关键.


科目:高中化学 来源: 题型:选择题
| A. | 先加入BaCl2溶液,再加入足量的HCl溶液,产生了白色沉淀.溶液中一定含有大量的SO42- | |
| B. | 加入足量的CaCl2溶液,产生了白色沉淀.溶液中一定含有大量的CO32- | |
| C. | 加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体.溶液中一定含有大量的NH4+ | |
| D. | 先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀.溶液中一定含有大量的Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3)2CHCH3 | C. | (CH3)2CH-CH(CH3)2 | D. | (CH3)3CCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | ||
| X | ||
| Z |
| A. | Y是非金属性最强的元素 | B. | Z是金属元素 | ||
| C. | Y的原子序数为a-7 | D. | X的气态氢化物化学式为H2X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 将Na块投入水中,产生气体:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 0.1 mol•L-1亚硫酸氢钠溶液的pH约为3:HSO3-+H2O═SO32-+H3O+ | |
| D. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
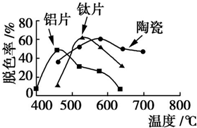 在不同的载体(钛片、铝片、陶瓷)表面制备TiO2薄膜,探究不同载体下TiO2薄膜光催化使甲基橙脱色的效果,每光照20min取一次样,实验结果如图所示.下列说法正确的是( )
在不同的载体(钛片、铝片、陶瓷)表面制备TiO2薄膜,探究不同载体下TiO2薄膜光催化使甲基橙脱色的效果,每光照20min取一次样,实验结果如图所示.下列说法正确的是( )| A. | 不同载体,无论何种温度一定是钛片载体的光催化活性最好 | |
| B. | 无论何种载体,催化活性总是随温度的升高而升高 | |
| C. | 约在520℃时,钛片载体的光催化活性最好 | |
| D. | 不同载体,TiO2薄膜的光催化活性相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com