
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算混合气体的总的物质的量,设CO的物质的量为x,CO2的物质的量为y,根据质量之和与物质的量之和列式计算CO和CO2的物质的量,根据分子式计算C、O原子物质的量,进而计算C、O原子数目之比;根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算平均摩尔质量,进而确定平均相对分子质量,根据ρ=$\frac{m}{V}$计算混合气体的密度;
(2)CuSO4的物质的量不变,根据稀释定律,计算混合后溶液的体积;
结合混合后硫酸的浓度,根据n=cV计算混合后n(H2SO4),进而计算加入的硫酸的物质的量,密度为1.84g/cm3、质量分数为98%的浓硫酸的物质的量浓度为$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,再根据V=$\frac{n}{c}$计算需要加浓硫酸溶液的体积,进而计算加入水的体积.
解答 解:标准状况下,混合气体的物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol,
设CO的物质的量为x,CO2的物质的量为y,则:$\left\{\begin{array}{l}{x+y=0.3}\\{28x+44y=12}\end{array}\right.$
解得:x=0.075mol,y=0.225mol,
此混合物中CO和CO2物质的量之比=0.075mol:0.225mol=1:3;
C和O原子个数比=(0.075mol+0.225mol):(0.075mol+0.225mol×2)=4:7;
混合气体的平均摩尔质量=$\frac{12g}{0.3mol}$=40g/mol,故平均相对分子质量是40;
混合气体的密度=$\frac{12g}{6.72L}$=1.79 g/L,
故答案为:1:3;4:7;40;1.79;
(2)CuSO4的物质的量不变,根据稀释定律,令混合后溶液的体积为V,则:
400mL×1mol/L=V×0.2mol/L,解得V=2000mL,
混合后溶液中n(H2SO4)=2L×2mol/L=4mol,
故加入的硫酸的物质的量为:4mol-0.4L×0.5mol/L=3.8mol,
密度为1.84g/cm3、质量分数为98%的浓硫酸的物质的量浓度为$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
需要加入浓硫酸的体积为$\frac{3.8mol}{18.4mol/L}$=0.2L=200mL,
则需要加入水的体积为2000mL-400mL-200mL=1400mL,
故答案为:2000;200;1400.
点评 本题考查混合物计算、物质的量有关计算,(2)中根据硫酸铜的物质的量不变计算混合后溶液的体积是关键,难度中等.


科目:高中化学 来源: 题型:选择题
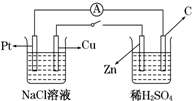 如图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是( )
如图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是( )| A. | Cu极为原电池负极 | |
| B. | Cu极附近OH-浓度增大 | |
| C. | 电子流向是由C极流向Pt极 | |
| D. | 当C极上有4 mol电子转移时,Pt极上有1 mol O2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸可除水垢 | |
| B. | 甘油可做护肤保湿剂 | |
| C. | 包装用的聚氯乙烯属于烃 | |
| D. | 酯类物质是形成水果香味的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应2Mg+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+C△H<0从熵变角度看,可以自发进行 | |
| B. | 在密闭容器发生可逆反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-113.0kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,△H变小 | |
| C. | 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 | |
| D. | 根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
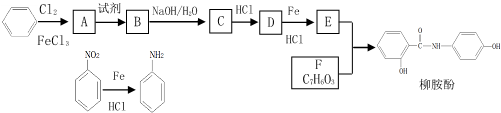
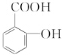 .
.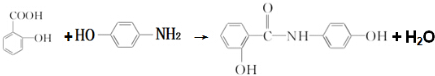 .
.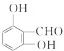 、
、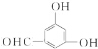 、
、 (任写一种)(任意写出一种结构简式).
(任写一种)(任意写出一种结构简式). )是染料工业中最重要的中间体之一,参照E的上述合成路线,设计一个以苯为原料制备苯胺的合成路线
)是染料工业中最重要的中间体之一,参照E的上述合成路线,设计一个以苯为原料制备苯胺的合成路线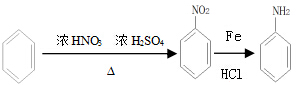 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
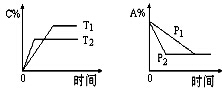 可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )| A. | T1<T2 △H>0 | B. | T1>T2 △H<0 | ||
| C. | P1<P2 a=c+d | D. | P1<P2 a+b=c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com