
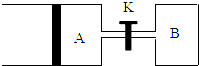
 按要求填空:
按要求填空:分析 (1)计算酸、碱的物质的量,判断过量,再计算pH;
(2)计算出碱溶液混合后的c(OH-),根据Kw=c(OH-)×c(H+)=10-14可计算出c(H+),最后计算出溶液的pH;
(3)根据图象知,A保持恒压,B保持恒容,
①先根据相同条件下,气体的气体之比等于物质的量之比计算平衡后气体的物质的量,再结合方程式计算X反应的物质的量,最后根据转化率公式计算X的转化率;
②结合B装置中压强对化学平衡的影响判断X的转化率大小;
③根据等温、等压条件下,气体的体积之比等于物质的量之比,已知A中充入1molX和1molY的体积为1.2aL,则打开K,相当于充入了3molX和3molY,所以AB总体积为3.6aL,从而得出A的体积.
解答 解:(1)盐酸是一元强酸,氢氧化钡是二元强碱,将0.1mol/L盐酸和0.06mol/L氢氧化钡溶液等体积混合后,氢氧化钡有剩余,该混合溶液中氢氧根离子浓度为:$\frac{0.06mol/L×2-0.1mol/L}{2}$=0.01mol/L,
则溶液中氢离子浓度为:$\frac{1{0}^{-14}}{0.01}$mol/L=10-12 mol/L,所以混合溶液的pH=-lg10-12=12,
故答案为:12;
(2)常温下pH=9的Ba(OH)2溶液中c(OH-)=10-5mol/L,pH=12的KOH溶液中c(OH-)=10-2mol/L,
按4:1的体积比混合,c(OH-)=$\frac{4×1{0}^{-5}+1{0}^{-2}}{5}$mol/L≈0.2×10-2mol/L,
则c(H+)=$\frac{1×1{0}^{-14}}{0.2×1{0}^{-2}}$=5×10-12mol/L,该溶液的pH=-lg5×10-12=12-lg5=11.7,
故答案为:11.3;
(3)①等压、等温条件下,气体的体积之比等于气体的物质的量之比,2mol气体时,体积为aL,达到平衡时,VA=1.2a L,所以平衡后混合气体的物质的量是2.4mol,
设A物质反应了mmol,
X(g)+Y(g)?2Z(g)+W(g) 物质的量增多
1mol 1mol
nmol (2.4-2)mol
n=0.4
所以X物质的转化率=$\frac{0.4mol}{1mol}$×100%=40%;
②B装置是在等容条件下,反应向正反应方向移动时,混合气体的物质的量增大,导致容器内气体压强增大,增大压强能抑制X的转化率,所以X的转化率减小,所以B容器中X的转化率比A小,
故答案为:>;
③当打开K时,整个装置是在等温、等压条件下反应,使整个装置中气体的压强与A装置中的初始压强相同时;向A中充入1molX和1molY达到平衡时,VA=1.2aL;当打开K时,AB中气体共为3molX和3molY,由于整个装置是在等温、等压条件下的反应,达到平衡状态时,混合气体的体积是3.6aL,其中B是aL,所以A为2.6aL,
故阿阿为:2.6a.
点评 本题考查了化学平衡的计算、溶液pH的计算,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握溶液酸碱性与溶液pH的关系及计算方法,试题培养 留学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 若混合气体的密度不再改变时,该反应不一定达到平衡状态 | |
| B. | 2min后,加压会使正反应速率增大,逆反应速率减小,平衡正向移动 | |
| C. | 反应过程中A和B的转化率之比为3:1 | |
| D. | 该条件下此反应的化学平衡常数的数值约为0.91 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无水CuSO4 | B. | CuO | C. | Cu(OH)2 | D. | CuCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究和开发CO2 和CO的创新利用是环境保护和资源利用的双赢的课题.
研究和开发CO2 和CO的创新利用是环境保护和资源利用的双赢的课题.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 组成物质分别是 | |||||
| 质 量 为(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
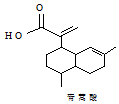
| A. | 青蒿酸的分子式为C15H20O2 | |
| B. | 1mol青蒿酸最多可与3molH2加成 | |
| C. | 青蒿酸与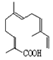 互为同分异构体 互为同分异构体 | |
| D. | 苯环上连有-CHO和-OH、分子中有6种不同化学环境氢的青蒿酸的同分异构体只有2种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com