
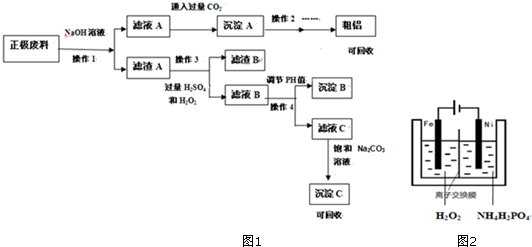
分析 锂离子电池正极材料(成份为LiFePO4、碳粉和铝箔)氢氧化钠溶液溶解,过滤得滤渣A中含有LiFePO4、碳粉,滤液A中含有四羟基合铝酸钠,滤液A中通入二氧化碳得沉淀A为氢氧化铝,氢氧化铝经过灼烧分解、电解可得铝,滤渣A中加入双氧水、硫酸,过滤得滤渣B为碳粉,滤液B的主要成分为Fe3+、Li+、PO43-,调节滤液B的PH值,过滤,可得沉淀B为氢氧化铁,滤液C中含有Li+、PO43-,滤液C中加入碳酸钠可得沉淀C为Li2CO3,据此答题.
解答 解:锂离子电池正极材料(成份为LiFePO4、碳粉和铝箔)氢氧化钠溶液溶解,过滤得滤渣A中含有LiFePO4、碳粉,滤液A中含有四羟基合铝酸钠,滤液A中通入二氧化碳得沉淀A为氢氧化铝,氢氧化铝经过灼烧分解、电解可得铝,滤渣A中加入双氧水、硫酸,过滤得滤渣B为碳粉,滤液B的主要成分为Fe3+、Li+、PO43-,调节滤液B的PH值,过滤,可得沉淀B为氢氧化铁,滤液C中含有Li+、PO43-,滤液C中加入碳酸钠可得沉淀C为Li2CO3,
(1)根据影响反应速率的因素可知,提高操作1浸出率的方法有升温,搅拌,增大浓度,增加时间等,
故答案为:升温,搅拌,增大浓度,增加时间等;
(2)操作3中加入双氧水,将亚铁离子氧化成铁离子,反应的离子方程式为:2LiFePO4+H2O2+2H+=2Fe3++2Li++2PO43-+2H2O,
故答案为:2LiFePO4+H2O2+2H+=2Fe3++2Li++2PO43-+2H2O;
(3)锂电池充电时的正极即为阳极,发生氧化反应,反应式为LiFePO4 -e-=FePO4+Li+,
故答案为:LiFePO4 -e-=FePO4+Li+;
(4)操作4中是调节PH值,使得铁离子沉淀完全,应选择试剂为NaOH,由于Ksp[Fe(OH)3]=4×10-38
,要使铁离子沉淀完全,即c(Fe 3+ )<10-5mol/L,所以此时c(OH- )>$\root{3}{\frac{4×10{\;}^{-38}}{10{\;}^{-5}}}$=$\root{3}{4}$×10-11mol/L,即pH=3.2,所以要将溶液调节pH值至PH>3.2,
故答案为:NaOH;大于3.2;
(5)根据上面的分析可知,沉淀C的成分为Li2CO3,
故答案为:Li2CO3;
(6)磷酸铁也可以通过电解法制备,如右图2,铁作阳极生成亚铁离子,亚铁离子被双氧水氧化成铁离子,再结合磷酸根离子生成磷酸铁,所以制备过程的总反应离子方程式为:Fe2++H2O2+2PO43-=2FePO4+H2O,
故答案为:Fe2++H2O2+2PO43-=2FePO4+H2O.
点评 本题为生产流程题,涉及金属的回收、氧化还原反应、物质的分离、金属的冶炼,有关方程式的计算等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息,难度中等.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 3 mol | B. | $\frac{3}{2}$mol | C. | $\frac{3}{8}$mol | D. | $\frac{8}{3}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏水湿润的试纸测某溶液的pH,一定会使结果偏低 | |
| B. | 可用酸式滴定管准确量取10.00mLKMnO4溶液 | |
| C. | 在中和热测定实验中,不能用温度计来搅拌溶液 | |
| D. | 将乙烯通入酸性高锰酸钾溶液,可检验乙烯的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH是氧化剂 | B. | C2H5OH发生氧化反应 | ||
| C. | CrO3是还原剂 | D. | H2SO4是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. ,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com