
【题目】现有A~I 9种短周期元素,它们在元素周期表中的位置如下.请据此回答下列问题:
A | ||||||||
D | E | I | ||||||
B | C | F | H | G | ||||
(1)下列中的元素的原子间反应最容易形成离子键的是
A.C和F
B.B和G
C.D和G
D.B和E
(2)下列由A~G形成的各分子中所有原子都满足最外层为8电子结构的是 .
A.EA3
B.AG
C.FG5
D.DG4
(3)由A,E组成的一种化合物化学式为EA5 , 其各原子均达到同周期稀有气体原子的稳定结构,试写出该化合物的电子式 .
(4)B,C,H,G形成的简单离子半径由大到小
(5)A与I形成1:1的化合物的结构式为
(6)写出B的最高价氧化物的水化物与G的最高价氧化物的水化物反应方程式:
写出HI2使酸性高锰酸钾褪色的离子方程式: .
【答案】
(1)B
(2)D
(3)![]()
(4)S2﹣>Cl﹣>Na+>Al3+
(5)H﹣O﹣O﹣H
(6)NaOH+Al(OH)3=NaAlO2+2H2O;5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+
【解析】解:由元素在周期表中位置知:A为H,B为Na,C为Al,D为C,E为N,F为P,I为O,H为S,G为Cl.(1)活泼金属和活泼非金属元素之间易形成离子键,这几种元素中金属性最强的是Na元素、非金属性最强的是Cl,所以B和G最容易形成离子键,故选B;(2)A.EA3为NH3 , 氢化物中H原子一定不能达到8电子结构,故A错误;B.AG为HCl,氢化物中H原子一定不能达到8电子结构,故B错误;C.PCl5分子中P元素化合价为+5价,其最外层电子数是5,5+5=10,所以该分子中并不是所有原子达到8电子结构,故C错误;D.DG4为CCl4 , C元素化合价为+4价、其最外层电子数是4,4+4=8,所以该分子中所有原子都达到8电子结构,故D正确;故选D;(3)由H、N组成的一种化合物化学式为NH5 , 其各原子均达到同周期稀有气体原子的稳定结构,该化合物化学式为NH4H,属于离子化合物,其电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(4)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大,故离子半径:S2﹣>Cl﹣>Na+>Al3+ , 所以答案是:S2﹣>Cl﹣>Na+>Al3+;(5)A与I形成1:1的化合物为H2O2 , 结构式为H﹣O﹣O﹣H,所以答案是:H﹣O﹣O﹣H;(6)B、G的最高价氧化物的水化物分别为NaOH、Al(OH)3 , 二者反应生成偏铝酸钠与水,反应方程式为:NaOH+Al(OH)3=NaAlO2+2H2O,SO2被酸性高锰酸钾氧化生成硫酸,同时还原得到Mn2+ , 反应离子方程式为:5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+ , 所以答案是:NaOH+Al(OH)3=NaAlO2+2H2O;5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+ .
;(4)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大,故离子半径:S2﹣>Cl﹣>Na+>Al3+ , 所以答案是:S2﹣>Cl﹣>Na+>Al3+;(5)A与I形成1:1的化合物为H2O2 , 结构式为H﹣O﹣O﹣H,所以答案是:H﹣O﹣O﹣H;(6)B、G的最高价氧化物的水化物分别为NaOH、Al(OH)3 , 二者反应生成偏铝酸钠与水,反应方程式为:NaOH+Al(OH)3=NaAlO2+2H2O,SO2被酸性高锰酸钾氧化生成硫酸,同时还原得到Mn2+ , 反应离子方程式为:5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+ , 所以答案是:NaOH+Al(OH)3=NaAlO2+2H2O;5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+ .


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知有机物C的分子式为C9H9OCl,分子中有一个苯环,苯环上只有一个侧链且不含甲基,一定条件下C能发生银镜反应。C与其他物质之间的转化如图所示(部分无机产物已略去):

(1)F中官能团的名称是_____________________;C→F的反应类型是____________。
(2)C的结构简式是______________________,I的结构简式是__________________。
(3)D与银氨溶液反应的化学方程式为_________________________________。
(4)有的同学认为B中可能没有氯原子,理由是_______________________。
(5)D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件的W的同分异构体有________种,写出其中核磁共振氢谱有4个峰且能发生银镜反应的结构简式___________________。
①属于芳香族化合物
②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017新课标Ⅲ]氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:
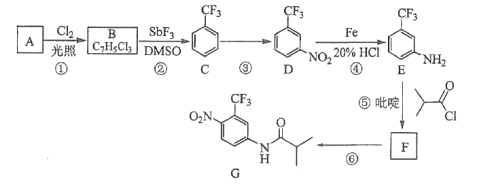
回答下列问题:
(1)A的结构简式为____________。C的化学名称是______________。
(2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】共价键、金属键、离子键和分子间作用力都是构成物质微粒间的不同相互作用力,含有上述中的三种相互作用力的晶体是( )
A. SiO2晶体 B. CCl4晶体 C. NaCl晶体 D. 石墨晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的用途,说法错误的是
A.燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施
B.漂白粉可用于生活用水的消毒
C.二氧化碳可用作镁燃烧的灭火剂
D.Ba2+浓度较高时危害健康,但BaS04可服入体内,作为造影剂用于X射线检查胃肠道疾病
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一小块钠投入盛有煤油(与水不相溶)和水的烧杯中,可以观察到的现象是
A. 钠浮在烧杯中的液面上 B. 钠沉在烧杯的底部
C. 钠会在水和煤油的交界面上下浮动,直到反应结束 D. 煤油会燃烧起来,产生很浓的黑烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在固定容积的密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中气体的压强不再发生变化
④单位时间内生成n mol Z,同时生成n mol X
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对各组物质性质的比较中,不正确的是( )
A.熔点:Li>Na>K
B.空间利用率:体心立方堆积<六方最密堆积<面心立方最密堆积
C.密度:Na<Mg<Al
D.导电性:Ag>Cu>Al>Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,1体积水溶解700体积氨气,所得溶液密度为0.9gcm﹣3 , 这种氨水的物质的量浓度和溶质的质量分数分别为( )
A.18.4molL﹣1 34.7%
B.20.4molL﹣1 38.5%
C.18.4molL﹣1 38.5%
D.20.4molL﹣1 34.7%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com