
����Ŀ��Ԫ�ظ�(Cr)����Ȼ����Ҫ�ԣ�3�ۺͣ�6�۴��ڡ��ش��������⣺
(1)��6�۵�Cr������ϸ������������岻��������Na2SO3��Cr2O72����ԭΪCr3������Ӧ�����ӷ���ʽΪ____________________��
(2)���ø�����(FeO��Cr2O3)ұ����ȡ�������Ĺ���������ͼ��ʾ��
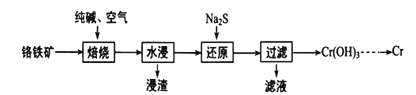
��Ϊ�ӿ챺�����ʺ����ԭ�ϵ������ʣ��ɲ�ȡ�Ĵ�ʩ��_________(дһ��)��
����ˮ������Ҫ��ý���Һ�IJ�����_______������Һ����Ҫ�ɷ�ΪNa2CrO4��������Һ���м����ữ���Ȼ�����Һ�а�ɫ�������ɣ�������ԭ�������з�����Ӧ�����ӷ���ʽΪ______��
�ۼ���Cr(OH)3�ɵõ�Cr2O3���ӹ�ҵ�ɱ��Ƕȿ��ǣ���Cr2O3��ȡ����Cr��ұ��������_________��
���𰸡�3SO32-+8H++Cr2O72��=2Cr3++3SO42-+4H2O ����������� ���� 3S2-+20H2O+8Cr2O72��=8Cr(OH)3��+3SO42- +16OH- �����£���CO��ԭ���Ȼ�ԭ��
��������
(1)��Ӧ�и�Ԫ�ػ��ϼ۴ӣ�6�۽�Ϊ+3�ۣ���Ԫ�ش�+4�����ߵ�+6�ۣ����ݵ�ʧ�����غ㣬ԭ�Ӹ����غ㣬���ӷ�Ӧ����ʽΪ3SO32-+8H++Cr2O72��=2Cr3++3SO42-+4H2O��
(2)��Ӱ�컯ѧ��Ӧ���ʵ����������Ҫ�����ʵı������С�������Խ��Ӧ����Խ�죬��Ϊ�ӿ챺�����ʺ����ԭ�ϵ������ʣ��ɲ�ȡ�Ĵ�ʩ�Ƿ��������
����ˮ����Ҫ��ý���Һ��Ҫ���˳���������ȡ�IJ����ǹ��ˣ�����Һ����Ҫ�ɷ�ΪNa2CrO4��������Һ���м����ữ���Ȼ�����Һ�а�ɫ�������ɣ�˵�������Na2S��������SO42-��CrԪ����+6�۽�Ϊ+3�ۣ�SԪ����-2������+6�ۣ�����ԭ���غ�͵�ʧ�����غ㣬�õ���ӦΪ3S2-+20H2O+8Cr2O72��=8Cr(OH)3��+3SO42- +16OH-��
�۴ӹ�ҵ�ɱ��Ƕȿ��ǣ���Cr2O3��ȡ����Cr�����Բ�ȡCO���»�ԭCr2O3 (�Ȼ�ԭ��)��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����顢��ϩ�dz����Ļ���ԭ�ϡ�
��1������ķ��ӹ���Ϊ___������ƽ������������������������������
��2��д�������������������֮��Ϊ1��1������Ӧ�Ļ�ѧ����ʽ��___���÷�Ӧ������Ϊ___��Ӧ��
��3����ϩ�к��й����ŵ�����Ϊ___��
��4��д����ϩ������������Ӧ�Ļ�ѧ����ʽ��___���÷�Ӧ������Ϊ___��Ӧ��
��5�������Լ���������������ϩ����___������ĸ����
a.��ˮ
b.���Ը��������Һ
c.NaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���3�������Ϊ1.0 L�ĺ����ܱ������з�Ӧ2H2(g)��CO(g)![]() CH3OH(g)�ﵽƽ�⣬����˵����ȷ����( )
CH3OH(g)�ﵽƽ�⣬����˵����ȷ����( )
���� | �¶�/K | ���ʵ���ʼŨ��/mol��L��1 | ���ʵ�ƽ��Ũ��/mol��L��1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
�� | 400 | 0.20 | 0.10 | 0 | 0.080 |
�� | 400 | 0.40 | 0.20 | 0 | |
�� | 500 | 0.20 | 0.10 | 0 | 0.025 |
A. �÷�Ӧ������Ӧ����
B. �ﵽƽ��ʱ���������з�Ӧ��ת���ʱ��������еĴ�
C. �ﵽƽ��ʱ����������c(H2)������������c(H2)������
D. �ﵽƽ��ʱ���������е�����Ӧ���ʱ��������еĴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���У���Ӧ�������Լ����۶���ȷ����
ѡ�� | ʵ�� | ���� | ���� |
A | ��Ƶε�����Ƭ�� | ����Ƭ���� | ��������Ԫ�ر��� |
B | ���Թ���CH4��Cl2����1��1��ϣ����ڹ����� | �Թ���������ɫ��dz���Թܱڳ�����״Һ�Σ������а��� | ���������£�CH4��Cl2�����˻�ѧ�仯 |
C | ��20%������Һ�м�������ϡ���ᣬ���ȣ��ټ�������������ͭ���ټ��������� | ���������� | ����δ����ˮ�� |
D | С�鼦Ƥ�ϵμ�3��5��Ũ���� | ��Ƥ�ɰױ�� | �����ʶ��ܷ�����ɫ�仯 |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA���������ӵ�������ֵ������˵����ȷ����
A. ���³�ѹ�£�124 g P4������P��P����ĿΪ4NA
B. 100 mL 1mol��L1FeCl3��Һ������Fe3+����ĿΪ0.1NA
C. ��״���£�11.2 L�������ϩ������к���ԭ����ĿΪ2NA
D. �ܱ������У�2 mol SO2��1 mol O2����Ӧ���������Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ɽ������Ӧ�ù㷺��ʳƷ������������ӽṹ��ͼ��ʾ������˵���������
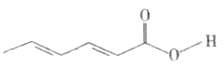
A.ɽ����ķ���ʽΪC6H8O2
B.1 molɽ����������2 mol Br2�����ӳɷ�Ӧ
C.ɽ�������ʹϡKMnO4������Һ��ɫ��Ҳ���봼�����û���Ӧ
D.ɽ�������������̼ԭ�ӿ��ܹ�ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��ȷ����( )��
A.��Ũ������������̷�Ӧ��ȡ����������MnO2+4HCl![]() Mn2+ + 2Cl-+ Cl2��+2H2O
Mn2+ + 2Cl-+ Cl2��+2H2O
B.��NaHCO3��Һ�еμ�����Ca(OH)2��![]() + Ca2+ + OH�T CaCO3��+ H2O
+ Ca2+ + OH�T CaCO3��+ H2O
C.������ˮ��Ӧ��Cl2 + H2O �T 2H+ + Cl- +ClO-
D.NaClO��Һ��ͨ��������SO2��3ClO��+H2O+SO2�TCl��+![]() +2HClO
+2HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��ɫ��Һ�����п��ܺ���Fe3+��Al3+��Fe2+��Mg2+��Cu2+��NH4����K+��CO32����SO42�������ӵļ��֣�Ϊ������ɷ֣�ȡ����Һ�ֱ�������ĸ�ʵ�飬��������й�������ͼ��ʾ��

���������ͼ�ƶ���
��1��ԭ��Һ��һ�����ڵ���������_______________����___(����������������������)�ԡ�
��2��ʵ����в�����ɫ��ζ�����������Ļ�ѧ����ʽΪ__________________________________��
��3��д��ʵ�����A���Ӧ�����Ļ�ѧʽ��__________��
��4��д��ʵ���������A��B��������������Ӧ�����ӷ���ʽ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ݹ����ŵIJ�ͬ�������л�����з���(�����)��

(1)��������_____________ ��
(2)±������_____________��
(3)����_______________ ��
(4)�ӣ�_____________��
(5)ȩ��_______________ ��
(6)ͪ��_____________��
(7)���_____________ ��
(8)����_____________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com