
某负二价元素A的气态氢化物含氢的质量分数为5.88%,0.9 g B元素的单质和足量的盐酸反应,生成了BCl3和1.12 L H2(标准状况),在C、B化合生成的盐的水溶液中,滴加AgNO3溶液,生成了不溶于硝酸的白色沉淀。指出A、B、C的元素名称A_____,B_____,C_____。
科目:高中化学 来源: 题型:
| 熔点 | 沸点 | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
| 元素 | X | F | |
| 电离能kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:湖南省月考题 题型:实验题
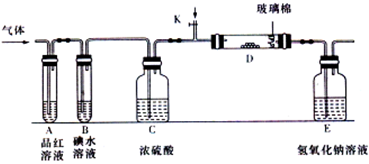
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com