
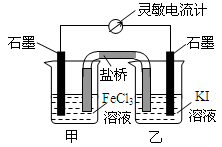
| A. | 反应开始时,甲池中电极反应为Fe3++e-=Fe2+ | |
| B. | 反应开始时,盐桥中的阴离子向乙池迁移 | |
| C. | 反应处于化学平衡状态时,甲、乙两池中离子浓度不再变化 | |
| D. | 反应处于化学平衡状态时,电子沿着石墨(乙池)→电流计→石墨(甲池)路径流动 |
分析 该装置是原电池,根据电池反应式知,甲中铁离子得电子发生还原反应,则甲中石墨作正极,乙中石墨作负极,
A.反应开始时,甲中电极上铁离子得电子发生还原反应;
B.反应开始时,盐桥中阴离子向负极区域移动、阳离子向正极区域移动;
C.反应达到平衡状态时,甲、乙池中离子浓度不变;
D.反应达到平衡状态时,甲、乙池中离子浓度不变,没有电流产生.
解答 解:该装置是原电池,根据电池反应式知,甲中铁离子得电子发生还原反应,则甲中石墨作正极,乙中石墨作负极,
A.反应开始时,甲中电极上铁离子得电子发生还原反应,电极反应式为Fe3++e-=Fe2+,故A正确;
B.反应开始时,盐桥中阴离子向负极区域移动、阳离子向正极区域移动,所以阴离子向乙池迁移,故B正确;
C.反应达到平衡状态时,正逆反应相等,甲、乙池中离子浓度不变,故C正确;
D.反应达到平衡状态时,甲、乙池中离子浓度不变,没有电流产生,电流计读数为0,故D错误;
故选D.
点评 本题以原电池为载体考查化学平衡、原电池原理,侧重考查基本原理,明确原电池正负极发生的反应、盐桥中阴阳离子移动方向、平衡状态特点即可解答,易错选项是D.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
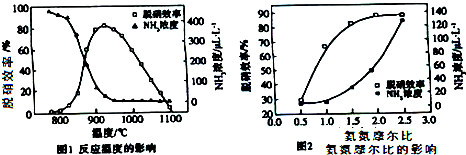
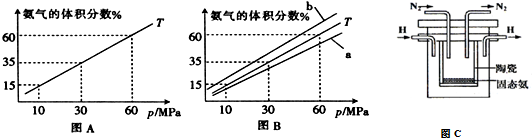
| A. | 从图1判断,该反应的正反应方向是放热反应 | |
| B. | 从图2判断,减少氨气的浓度有助于提高NO的转化率 | |
| C. | 从图1判断,脱硝的最佳温度约为925℃ | |
| D. | 从图2判断,综合考虑脱硝效率和运行成本最佳氨氮摩尔比应为2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
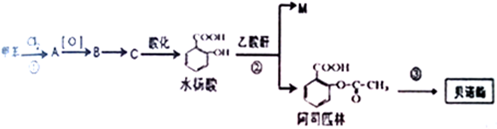
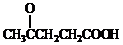 )合成聚芳酯E的路线(省略部分产物):
)合成聚芳酯E的路线(省略部分产物):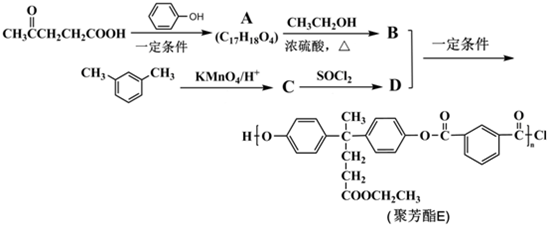
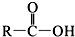 +SOCl2→
+SOCl2→ +SO2+HCl
+SO2+HCl +R′OH→
+R′OH→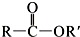 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)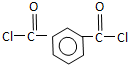 .
.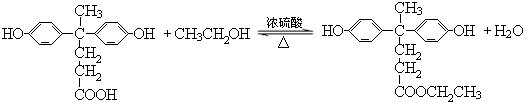 ,.
,.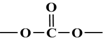 结构写出F与足量NaOH溶液共热反应的化学方程式:
结构写出F与足量NaOH溶液共热反应的化学方程式: .
.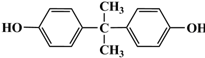 的路线.
的路线.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ||||||||||||||
| ⑥ | ⑦ | ⑧ | |||||||||||||||
| ⑨ | ⑩ |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
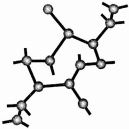 氮化硅是一种新型无机非金属材料,主要有α-氮化硅和β-氮化硅两种晶型,它们都是由[SiN4]正四面体共用顶角原子构成的三维空间网络结构,β-氮化硅的结构如图所示:
氮化硅是一种新型无机非金属材料,主要有α-氮化硅和β-氮化硅两种晶型,它们都是由[SiN4]正四面体共用顶角原子构成的三维空间网络结构,β-氮化硅的结构如图所示: ,若去掉氢原子后的剩余部分即Si44-(原硅酸根)为硅氧四面体结构,顶角上的4个氧原子称作“角氧”.3个硅氧四面体彼此用3个角氧相连后,形成离子的化学式为Si3O96-.n个硅氧四面体彼此用4个角氧连接后形成的物质的化学式是SiO2.
,若去掉氢原子后的剩余部分即Si44-(原硅酸根)为硅氧四面体结构,顶角上的4个氧原子称作“角氧”.3个硅氧四面体彼此用3个角氧相连后,形成离子的化学式为Si3O96-.n个硅氧四面体彼此用4个角氧连接后形成的物质的化学式是SiO2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
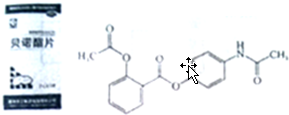
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/K | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 日常生活中的手电筒干电池通常是锌锰电池,其构造示意图如下:
日常生活中的手电筒干电池通常是锌锰电池,其构造示意图如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
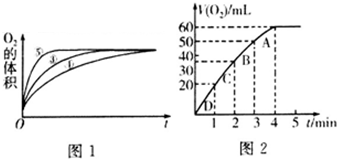
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com