
【题目】用98%的浓硫酸(密度为1.84g·cm-3)配制1mol·L-1的稀硫酸100 mL,现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒。按实验时使用仪器的先后顺序,排列正确的是 ( )
A.②⑥③⑦⑤⑥B.②③⑦⑤⑥C.①③⑤⑦④⑥D.④⑦③⑤⑥
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图
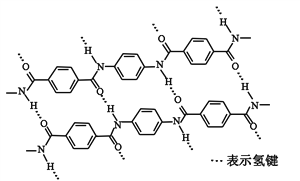
下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠晶体 ![]() 俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿
俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿![]() 主要成份为
主要成份为![]() ,还含有
,还含有![]() 、MgO、
、MgO、![]() 等杂质
等杂质![]() 为主要原料进行生产,其主要工艺流程如下:
为主要原料进行生产,其主要工艺流程如下:
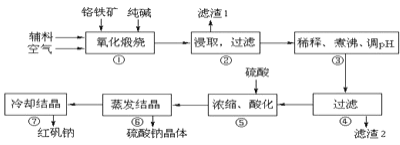
①中涉及的主要反应有:
主反应:![]()
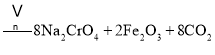
副反应: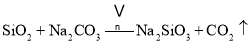 、
、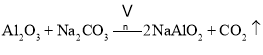
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 |
|
|
|
|
完全沉淀时溶液pH |
|
|
|
|
试回答下列问题:/span>
![]() “①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
![]() “③”中调节pH至
“③”中调节pH至![]() ,目的是 ______ .
,目的是 ______ .
![]() “⑤”中加硫酸酸化的目的是使
“⑤”中加硫酸酸化的目的是使![]() 转化为
转化为![]() ,请写出该平衡转化的离子方程式: ______ .
,请写出该平衡转化的离子方程式: ______ .
![]() 称取重铬酸钠试样
称取重铬酸钠试样![]() 配成250mL溶液,取出
配成250mL溶液,取出![]() 于碘量瓶中,加入10mL
于碘量瓶中,加入10mL![]() 和足量碘化钠
和足量碘化钠![]() 铬的还原产物为
铬的还原产物为![]() ,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用
,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用![]() 标准溶液滴定
标准溶液滴定![]()
①判断达到滴定终点的依据是: ______ ;
②若实验中共用去![]() 标准溶液
标准溶液![]() ,所得产品的中重铬酸钠晶体的纯度
,所得产品的中重铬酸钠晶体的纯度![]() 设整个过程中其它杂质不参与反应
设整个过程中其它杂质不参与反应![]() ______ .
______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.溴乙烷与少量乙醇的混合物加水除去乙醇的方法,原理类似于溴水中加四氯化碳萃取溴
B.中和滴定实验中,如用于盛放待测溶液的锥形瓶洗净后未干燥,不影响测定结果
C.由![]() 稀
稀![]() 构成的原电池,溶液中加入适量
构成的原电池,溶液中加入适量![]() 能提高电池放电效率
能提高电池放电效率
D.蛋白质与氨基酸遇到双缩脲试剂均会出现紫玫瑰色现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )
C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )

A.三种化合物的稳定性顺序:B<A<C
B.两步反应均为放热反应
C.该反应ΔH>0,加入催化剂不改变反应的焓变
D.整个反应的ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Q、Y、Z、M、R均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4,M原子的最外层电子数与次外层电子数之比为3∶4;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,Q和Y在周期表中的位置相邻。请回答下列问题。
(1)M原子的价电子排布图是__________,Q的常见氢化物的立体构型是_________________。
(2)写出X、Y、R按原子个数之比1∶1∶1形成的化合物的结构式:_______________。
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:_________。
(4)写出单质R的一种工业用途:_______________。
(5)图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,写出该转化过程的化学方程式:_______。

(6)由X、Y、Z、M四种元素可形成一种离子化合物A,已知A既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,写出A与氯水反应的离子方程式:_____。
(7)科学家认为存在QX5这种物质,且预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验 序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)写出草酸与高锰酸钾反应的离子方程式____________。
(2)通过实验A、B,可探究出________(填外部因素)的改变对化学反应速率的影响,其中V1=_______、T1=______/span>;通过实验______(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=_____。
(3)忽略溶液体积的变化,利用实验B中数据计算,0-8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=____mol·L-1·min-1。
(二)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10 mL 5% H2O2):

(1)上表试管Ⅰ中应添加的试剂为5滴____________。
(2)结论是_________,实验Ⅲ的目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH相同的NaOH溶液和![]() 溶液分别加水稀释
溶液分别加水稀释![]() 随溶液体积变化的曲线如图所示,则下列叙述正确的是
随溶液体积变化的曲线如图所示,则下列叙述正确的是![]()

A. b、c两点溶液的导电能力相同
B. c点溶液中c![]()
C. a、b、c三点溶液中水的电离程度![]()
D. 等体积的b、c两点溶液分别与相同浓度的盐酸恰好完全反应时,消耗盐酸的体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中微粒的物质的量浓度关系不正确的是
A.![]() 溶液与
溶液与![]() 溶液等体积混合:
溶液等体积混合:![]()
B.某温度下,![]() ,
,![]() ;将
;将![]()
![]() 的
的![]() 溶液滴入
溶液滴入![]()
![]() 的KCl和
的KCl和![]()
![]() 的
的![]() 溶液,则先产生
溶液,则先产生![]() 沉淀
沉淀
C.![]()
![]() 溶液与
溶液与![]()
![]() 溶液等体积混合:
溶液等体积混合:![]()
D.在![]()
![]() 氨水中滴加
氨水中滴加![]()
![]() 盐酸,刚好完全中和时
盐酸,刚好完全中和时![]() ,则由水电离产生的
,则由水电离产生的![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com