
| A、反应①中a的值为5,b的值为8 |
| B、该滴定过程中选择的指示剂是酚酞 |
| C、样品中w(FeSO4?7H2O)=2.78V×100% |
| D、反应②是为了消除Fe3+的棕黄色对终点判断的干扰 |
| 2.78V×10-2g |
| 1g |


科目:高中化学 来源: 题型:
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:
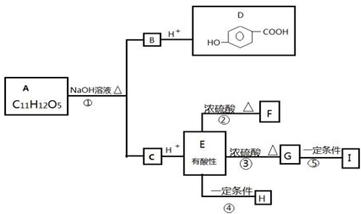
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷和乙烯 |
| B、甲烷和丙烯 |
| C、甲烷和丁烯 |
| D、乙烷和丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol/L的Na2HPO4溶液中存在如下的平衡;HPO42-?H++PO43-,加水稀释,使溶液中的HPO42-、H+、PO43-的浓度均减小 |
| B、饱和NH4Cl中:c(H+)+c(Cl-)=c(NH4+)+2c(NH3?H2O)+c(OH-) |
| C、常温下,0.1mol/L的HA和BOH两种溶液,其pH值分别为3和12,将两溶液等体积混合后,所得溶液的pH≤7 |
| D、在NH4HSO3与NH4Cl混合溶液中:c(NH4+)=c(SO32-)+c(HSO3-)+c(H2SO3)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
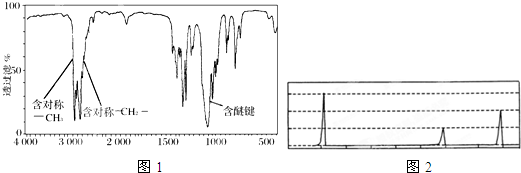
查看答案和解析>>
科目:高中化学 来源: 题型:
 为测定镁铝合金(不含其它元素)中铝的质量分数,甲、乙、丙三个学习小组设计了下列三种不同的实验方案进行探究.请回答下列问题:
为测定镁铝合金(不含其它元素)中铝的质量分数,甲、乙、丙三个学习小组设计了下列三种不同的实验方案进行探究.请回答下列问题:| 足量NaOH溶液 |
| 足量盐酸 |
| 足量盐酸 |
| 足量NaOH溶液 |
| 操作1 |
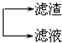
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和滴定,锥形瓶用待测液润洗后再使用 |
| B、中和热的测定,读取混合溶液的最高温度为终止温度 |
| C、实验室制氯气,用饱和食盐水吸收尾气 |
| D、蔗糖的水解,在蔗糖溶液中加稀硫酸加热,再加入银氨溶液验证水解产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com