

| A、原来盐酸的物质的量浓度为0.1 mol?L-1 |
| B、Y处溶液中只有两种离子 |
| C、原NaOH溶液的物质的量浓度为1 mol?L-1 |
| D、水的电离程度:X>Y>Z |


科目:高中化学 来源: 题型:
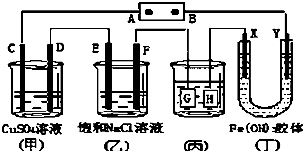
| A、若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则A极的电极反应式为:C2H6-14e-+18OH-=2CO32-+12H2O |
| B、欲用(丙)装置给铜镀银,H应该是Ag,电镀液选是AgNO3溶液 |
| C、(丁)装置中Y极附近红褐色变深,说明氢氧化铁胶体带正电荷 |
| D、C、D、E、F电极均有单质生成,且其物质的量比为1:2:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去NaCl溶液中的少量I2:用无水乙醇,萃取分液 |
| B、除去CO2中少量HCl:通入饱和Na2CO3溶液,洗气 |
| C、除去NaHCO3固体中少量Na2CO3:加热灼烧 |
| D、除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在即将到来的新能源时代,核能、太阳能、氢能将可能成为主要能源 |
| B、开发太阳能、氢能等新型能源有利于减少二氧化碳的排放量 |
| C、煤的气化技术是减少二氧化碳排放的重要措施 |
| D、煤的“气化”和“液化”技术可提高煤的综合利用效率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 大气臭氧层的分解反应时O3(g)+O(g)═2O2(g)△H,该反应的能量变化如图所示,已知氯原子对O3分解的催化原理为O3(g)+Cl(g)═ClO(g)+O2(g)△H1,ClO(g)+O(g)═Cl(g)+O2(g)△H2.下列判断正确的是( )
大气臭氧层的分解反应时O3(g)+O(g)═2O2(g)△H,该反应的能量变化如图所示,已知氯原子对O3分解的催化原理为O3(g)+Cl(g)═ClO(g)+O2(g)△H1,ClO(g)+O(g)═Cl(g)+O2(g)△H2.下列判断正确的是( )| A、△H=E2-E3 |
| B、E1-E3=△H1+△H2 |
| C、氯原子可使E1减少 |
| D、2O2═O3+O是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,4.6g NO2气体约含有1.81×1023个原子 |
| B、在标准状况下,80g SO3所占的体积约为22.4L |
| C、常温下,0.1mol?L-1醋酸溶液的pH约为1 |
| D、标准状况下,22.4L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
| B、乙烷和丙烯的物质的量共1mol,完成燃烧生成3mol H2O |
| C、用水可区分苯和溴苯 |
D、如图中有机物的一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )| A、产生的CO2体积(标准状况下)为0.056L |
| B、原NaOH溶液的物质的量浓度为0.5mol?L-1 |
| C、OA段所发生反应的离子方程式:H++OH-═H2O;CO32-+H+═HCO3- |
| D、NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com