
| A、将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu |
| B、室温下,饱和氯水中能大量存在C1-、Fe3+、NO3-、Na+、SO32- |
| C、浓度和体积相同的NaOH和CH3COOH相混合,溶液中c(Na+)>c(CH3COO-) |
| D、放电反应为H2+2NiO(OH)=2Ni(OH)2的电池,充电时,阴极上NiO(OH)被还原 |


科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、500 |
| B、600 |
| C、1 200 |
| D、1 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合溶液中只存在Na+、Fe3+、SO42-,不可能存在K+、CO32- |
| B、由实验①无法推断原混合溶液中是否含有SO42- |
| C、由实验①、②可判断原混合溶液中是否含有Fe3+ |
| D、由实验③可判断原混合溶液中存在Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
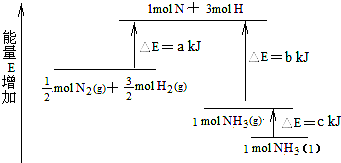
A、
| ||||
B、
| ||||
| C、N2(g)+3 H2(g)→2 NH3(g);△H=2(b-a)kJ/mol | ||||
| D、N2(g)+3 H2(g)→2 NH3(1);)△H=2(a-b-c)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
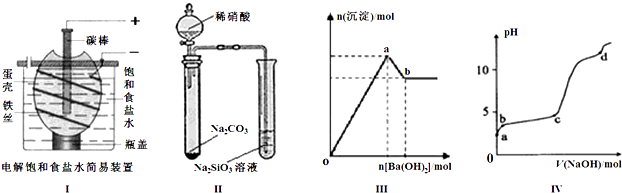
| A、按图Ⅰ装置电解一段时间后,往蛋壳外溶液中滴加几滴酚酞,溶液呈红色 |
| B、按图Ⅱ装置实验,可以证明酸性强弱关系为:硝酸>碳酸>硅酸 |
| C、图Ⅲ表示:向明矾溶液中逐滴加入Ba(OH)2溶液,生成沉淀的物质的量随Ba(OH)2加入量的变化曲线,则oa段发生的离子反应为: 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| D、图Ⅳ表示:室温时,将1mol?L-1 NaOH溶液逐滴滴入0.2mol?L-1 Al2(SO4)3溶液中,实验测得溶液pH随NaOH溶液体积变化曲线,则d点时Al(OH)3沉淀开始溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从碘水中提取碘单质,可选用酒精作有机萃取剂 |
| B、蒸馏操作时,应使温度计的水银球深入液体中 |
| C、与盐酸反应生成CO2,碳酸钠比碳酸氢钠快 |
| D、向Na2CO3和NaHCO3溶液中分别滴加酚酞试液,两者都显红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com