
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。M元素与X同主族,与W同周期。
(1)M元素是(填元素符号)。
(2)Z、W形成的气态氢化物的稳定性为>。(填化学式)
(3)写出M2Z2的电子式: , 写出M2Z2与水反应的离子方程式:。
(4)由X、Y、Z、W四种元素中的三种组成一种强酸,该强酸的稀溶液能与铜反应,离子方程式为。
(5)由X、Y、Z、W四种元素组成一种离子化合物A,已知:①1 mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体B,该气体能与氯水反应。则A是(填化学式)。写出气体B与氯水反应的离子方程式:。
【答案】
(1)Na
(2)H2O;H2S
(3)![]() ;2Na2O2+2H2O=4Na++4OH-+O2↑
;2Na2O2+2H2O=4Na++4OH-+O2↑
(4)3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
(5)(NH4)2SO3;SO2+Cl2+2H2O=SO42-+2Cl-+4H+
【解析】 由X的原子半径最小可知X为H;Y、Z、W的位置关系为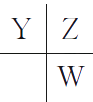 ,设Z的原子序数为x,则Y、W的原子序数分别为x-1、x+8,由题意知,1+x+x-1+x+8=32,x=8,则Y、Z、W分别为N、O、S,M为Na。(4)H、N、O、S中的三种元素可以组成两种强酸:H2SO4、HNO3 , 其中稀硝酸能与铜反应,而稀硫酸不能与铜反应。(5)四种元素组成的离子化合物一定含有NH4+ , 由①可知1 mol A含有2 mol NH4+ , 由②可知A中含有SO32- , 所以A为(NH4)2SO3。
,设Z的原子序数为x,则Y、W的原子序数分别为x-1、x+8,由题意知,1+x+x-1+x+8=32,x=8,则Y、Z、W分别为N、O、S,M为Na。(4)H、N、O、S中的三种元素可以组成两种强酸:H2SO4、HNO3 , 其中稀硝酸能与铜反应,而稀硫酸不能与铜反应。(5)四种元素组成的离子化合物一定含有NH4+ , 由①可知1 mol A含有2 mol NH4+ , 由②可知A中含有SO32- , 所以A为(NH4)2SO3。


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】下列变化中不属于氮的固定的是
A. 在一定条件下由氨气和二氧化碳合成尿素
B. 雷雨闪电时,大气中产生了一氧化氮
C. 豆科农作物的根瘤菌使空气中的氮转化为氨
D. 镁条在空气中燃烧生成氮化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在一定体积某浓度的BaCl2溶液中,逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2.若忽略两溶液混合时的体积变化,则加入稀硫酸的体积与原BaCl2溶液的体积比是( )
A.10:1
B.1:10
C.9:1
D.1:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于卤族元素的比较中,错误的是
A. 气态氢化物的稳定性:HF>HCl>HBr>HIB. 单质的氧化性:F2>Cl2>Br2>I2
C. 离子的还原性:F->Cl->Br->I-D. 元素的非金属性:F>Cl>Br>I
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中有HCHO、H2、O2共26.5g,用电火花引燃烧,使其完全燃烧,再将燃烧后的气体用Na2O2充分吸收,Na2O2增重10.5g,则原混合气体中O2的物质的量是( )
A.0.5 mol
B.0.25 mol
C.0.27 mol
D.0.52 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验某溶液中是否含有K+、Fe3+、Cl﹣、Mg2+、I﹣、CO32﹣、SO42﹣ , 限用的试剂有:盐酸硫酸、硝酸银溶液、硝酸钡溶液.设计如下实验步骤,并记录相关现象.下列叙述不正确的是( ) 
A.该溶液中一定有I﹣、CO32﹣、SO42﹣、K+
B.试剂①为硝酸钡
C.通过黄色溶液中加入硝酸银可以检验原溶液中是否存在Cl﹣
D.试剂②一定为盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.6g铁粉投入盛有200mL 含0.1mol硫酸的烧杯中,2min 时铁粉刚好溶解完全.如果反应前后溶液的体积不变,则该反应的平均速率可表示为( )
A.v(Fe)=0.5 molL﹣1min﹣1
B.v(H2SO4)=1 molL﹣1min﹣1
C.v(H2)=0.25 molL﹣1min﹣1
D.v(FeSO4)=0.25 molL﹣1min﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com