
下列关于常见有机物的说法中,正确的是( )
|
| A. | 汽油、苯、乙醇都属于烃类物质 |
|
| B. | 含5个碳原子的有机物,分子中最多可形成5个碳碳单键 |
|
| C. | 等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等 |
|
| D. | 二氧化硫和乙烯都能使溴水褪色,二者反应原理相同 |
考点:
乙醇的化学性质;乙烯的化学性质;乙酸的化学性质.
专题:
有机物的化学性质及推断;有机物分子组成通式的应用规律.
分析:
A、汽油、苯属于烃类,乙醇分子中含有氧原子,属于烃的衍生物;
B、对于环状化合物,含有5个碳原子的化合物最多可以形成5个碳碳键;
C、乙醇的分子式为C2H6O,1mol乙醇完全燃烧消耗3mol氧气;乙酸的分子式为C2H4O2,1mol乙酸完全燃烧消耗2mol氧气;
D、二氧化硫和乙烯都能使溴水褪色,前者是氧化反应,后者是加成反应.
解答:
解:A、乙醇分子中除了含有C、H元素外,还含有氧元素,所以乙醇不属于烃类,属于烃的衍生物,故A错误;
B、链状化合物中,5个C最多形成4个C﹣C键,而对于环状化合物中,5个C最多可以形成5个C﹣C键,故B正确;
C、1mol乙醇完全反应消耗3mol氧气,1mol乙酸完全反应消耗2mol氧气,所以等物质的量的二者完全燃烧,消耗的氧气的质量不相等,故C错误;
D、二氧化硫和乙烯都能使溴水褪色,前者是氧化反应,后者是加成反应,反应原理不同,故D错误.
故选B.
点评:
本题考查了常见有机物的组成结构与性质、反应原理等,题目难度中等,注意掌握常见有机物的结构与性质,注意环状化合物的特点.


科目:高中化学 来源: 题型:
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图所示,回答下列问题:
(1)若a=5,则A为 酸,B为 酸(填“强”、或“弱”),若再稀释100倍,则A的pH 7(填“<”、“>”或“=”).
(2)若A、B都是弱酸,则a的范围是 .

查看答案和解析>>
科目:高中化学 来源: 题型:
已知苯跟一卤代烷在催化剂作用下,可生成苯的同系物.
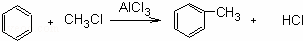
如在催化剂作用下,苯和下列各组物质合成乙苯最好应选用的是( )
|
| A. | CH3CH3和Cl2 | B. | CH2=CH2和Cl2 | C. | CH2=CH2和HCl | D. | CH≡CH和Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
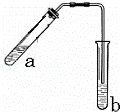
可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空:
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2mL,正确加入顺序操作是 ,
.为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是 )
(2)写出试管a中该反应化学方程式 ;
(3)实验中加热试管:
①开始时要小火加热的目的是:
②加热一段时间后改为大火加热至沸腾的目的是: 3加热至沸腾后再改为小火加热的目的是:
(4)试管b中加有饱和Na2CO3溶液,其作用是:
(5)试管b中导气管不插入液面下的目的是: 防 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: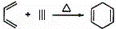 ,如果要合成
,如果要合成 ,所用的起始原料可以是( )
,所用的起始原料可以是( )
|
| A. | 2,3﹣二甲基﹣1,3﹣戊二烯和丙炔 |
|
| B. | 2,3﹣二甲基﹣1,3﹣戊二烯和乙炔 |
|
| C. | 2﹣甲基﹣1,3﹣丁二烯和2﹣丁炔 |
|
| D. | 1,3﹣戊二烯和2﹣丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现由C6H12,CH3CHO,CH3COOH组成的混合物,已知O质量分数为a%,则碳的质量分数为( )
|
| A. |
| B. | 1﹣a% | C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下反应2AB(g)⇌A2(g)+B2(g)达到平衡状态的标志是( )
|
| A. | 单位时间内生成3n molA2,同时消耗2n molAB |
|
| B. | 容器内,3种气体AB、A2、B2共存 |
|
| C. | AB的消耗速率等于A2的消耗速率 |
|
| D. | 容器中各组分的物质的量分数不随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E均是短周期元素,A和B同周期,A和C同族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与D的阳离子电子层结构相同,D的单质与B的单质在不同条件下反应,可生成D2B或D2B2,E是所在周期中原子半径最小的元素,请回答。
(1)C在元素周期表中的位置是_______.
(2)D2B的电子式是___________;AB2的结构式是____________.
(3)B、D、E离子半径的由大到小的顺序为___________;(用离子符号回答)A、C、E最高价氧化物对应水化物的酸性由强到弱的顺序为_________.(用化学式回答)
(4)A、B气态氢化物沸点高的是___________;(用化学式回答)原因_____________.
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生以为,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀,当消耗13.50g EB2时,共转移了1mol电子,则反应的离子方程式为_________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com