
| A. | 1L 0.1 mol•L-1的氨水中有0.1NA个NH4+ | |
| B. | 标准况下,22.4L盐酸含有NA个HCl分子 | |
| C. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为0.5 NA | |
| D. | 标准状况下,6.72 LN02与水充分反应转移的电子数目为0.2 NA |
分析 A、一水合氨为弱电解质;
B、盐酸中无HCl分子;
C、氮气和CO的摩尔质量均为28g/mol,且均为双原子分子;
D、求出二氧化氮的物质的量,然后根据3mol二氧化氮和水反应转移2mol电子来分析.
解答 解:A、一水合氨为弱电解质,不能完全电离,故溶液中的铵根离子的个数小于0.1NA个,故A错误;
B、HCl溶于水后完全电离,故盐酸中无HCl分子,故B错误;
C、氮气和CO的摩尔质量均为28g/mol,故14g混合物的物质的量为0.5mol,且两者均为双原子分子,故0.5mol混合物中含有的原子的个数为NA个,故C错误;
D、标况下6.72L二氧化氮的物质的量为0.3mol,而3mol二氧化氮和水反应转移2mol电子,故0.3mol二氧化氮反应转移0.2NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:解答题
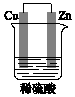 某原电池装置如图所示.
某原电池装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,可得:
某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,可得:查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 和
和
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Fe在0.1 mol Cl2中充分燃烧,转移的电子数为0.3NA | |
| B. | 1 mol CnH2n+2分子中含共价键数目为(3n+1)NA | |
| C. | 含NA个氧原子的O2与含NA个氧原子的O3的质量比为2:3 | |
| D. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn和H2SO4的总能量大于ZnSO4和H2的总能量 | |
| B. | 反应过程中能量关系可用如图表示 | |
| C. | 若将该反应设计成原电池,则Zn为负极 | |
| D. | 若将该反应设计成原电池,当有32.5g锌溶解时正极放出11.2L气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com