
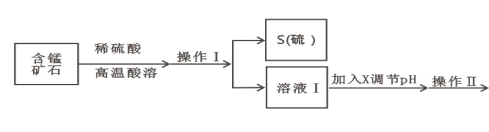
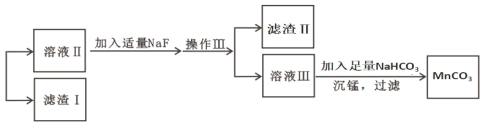
【题目】某含锰矿石的主要成分是 MnO2,还含 CaO、Al2O3、FeS 杂质,由此矿石生产 MnCO3 的工艺流 程如图所示:
已知:①相关金属离子生成氢氧化物沉淀的 pH 如表所示:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.8 | 4.7 |
Mn(OH)2 | 8.8 | 10.4 |
Ca(OH)2 | 12 | ─ |
②常温下,Ksp(CaF2)=3.95×10-11
回答下列问题:
(1)酸溶时,是否能将稀硫酸换成浓盐酸_____(填“ 是” 或“ 否” );操作 I 的名称 为_____。
(2)取溶液Ⅰ加入 KSCN 溶液,溶液呈血红色,试写出酸溶过程中 MnO2 与 FeS 发生反应的离子方程 式:_____。
(3)调节溶液Ⅰ的 pH 时,pH 的范围为_____;所用的物质 X 最好是_____(填字母)。
A.盐酸 B.NaOH 溶液 C.氨水 D.MnCO3 固体
(4)滤渣Ⅰ为_____,滤渣Ⅱ为_____。(填化学式)
(5)沉锰的化学方程式为_____。
(6)沉锰后过滤得到固体 MnCO3,设计实验方案验证 MnCO3 固体是否洗涤干净:_____。
【答案】否 过滤 2FeS + 12H+ + 3MnO2 = 2Fe3+ + 2S + 3Mn2+ + 6H2O 4.7≤pH<8.8 D Fe(OH)3、Al(OH)3 CaF2 MnSO4 + 2NaHCO3 = MnCO3↓ + Na2SO4 + H2O + CO2↑ 取少量最后一次洗涤液于试管中,滴入盐酸酸化的氯化钡溶液,若无沉淀产生,则说明已经洗涤干净。
【解析】
(1)酸溶时的条件为高温,盐酸沸点低,在高温下易挥发,不宜用盐酸;操作Ⅰ得到单质S沉淀,所以操作为过滤;故答案为:否、过滤;
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,说明有铁离子生成,所以酸溶过程中FeS发生反应的离子方程式为FeS + 12H+ +3MnO2![]() 2Fe3+ + 2S↓ + 3Mn2+ + 6H2O;故答案为:2FeS + 12H+ + 3MnO2 = 2Fe3+ + 2S + 3Mn2+ + 6H2O;
2Fe3+ + 2S↓ + 3Mn2+ + 6H2O;故答案为:2FeS + 12H+ + 3MnO2 = 2Fe3+ + 2S + 3Mn2+ + 6H2O;
(3)调节溶液Ⅰ的 pH目的是为了除去铁离子和铝离子,同时又不能让Mn2+转化为沉淀,则pH应控制在4.7至8.8之间;由于不能引入杂质,则调节溶液pH所用物质X最好为 MnCO3固体;故答案为:4.7≤pH<8.8、D;
(4)根据表中数据可知铁离子、铝离子完全沉淀,则滤渣Ⅰ为Al(OH)3、Fe(OH)3;滤液中还含有钙离子,则加入NaF后转化为氟化钙沉淀,即滤渣Ⅱ为CaF2。故答案为:Fe(OH)3、Al(OH)3;CaF2;
(5)沉锰的反应物是碳酸氢钠和硫酸锰,则反应的化学方程式为MnSO4 + 2NaHCO3 = MnCO3↓ + Na2SO4 + H2O + CO2↑。
(6)沉锰后过滤得到固体表面可能含有SO42-,若洗涤干净后的洗涤液中不含硫酸根离子,故答案为:取少量最后一次洗涤液于试管中,滴入盐酸酸化的氯化钡溶液,若无沉淀产生,则说明已经洗涤干净。


科目:高中化学 来源: 题型:
【题目】在某100 mL混合酸溶液中,HNO3和H2SO4的物质的量浓度分别为0.2 mol·L-1和0.4 mol·L-1,向该混合溶液中加入2.24 g铁粉,加热充分反应后,下列说法不正确的是
A. 生成的气体在标准状况下的体积为672 mLB. 生成的气体有NO和H2
C. 所得溶液中有溶质FeSO4和Fe2(SO4)3D. 所得溶液中Fe2+的物质的量浓度为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述的离子反应方程式正确的是
A. 少量的 SO2 通入 NaClO 溶液:SO2+H2O+2ClO-=SO32-+2HClO
B. 氧化铁溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
C. 用二氧化锰和浓盐酸反应制氯气:MnO2+4HCl(浓)![]() Mn2++2Cl―+Cl2↑+2H2O
Mn2++2Cl―+Cl2↑+2H2O
D. 等浓度的 NaHSO4 与 Ba(OH)2 混合至溶液呈中性:Ba2++2OH―+SO42―+2H+=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含 卤 族 元 素 的 化 合 物 在 科 研 和 生 产 中 有 许 多 重 要 用 途 。 如 : 2 m o l S b ( C H 3 ) 3 、 2 m o lSb(CH3)2Br 和 2molSb(CH3)Br2 进行重组反应可生成空间位阻最小的离子化合物:[Sb2(CH3)5]2 [Sb2(CH3)2Br6],已知 Sb 与 N 同主族。请回答:
(1) 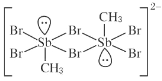 中,H、C、Br 的电负性由小到大的顺序为_____,溴原子的价电子排布式 为_____。
中,H、C、Br 的电负性由小到大的顺序为_____,溴原子的价电子排布式 为_____。
(2)[Sb2(CH3)5] +的结构式为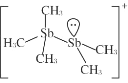 ,Sb 原子的杂化轨道类型为_____。写出一种与CH3 -互为等电子体的分子_____。
,Sb 原子的杂化轨道类型为_____。写出一种与CH3 -互为等电子体的分子_____。
(3)X 射线衍射测定等发现,I3AsF6 中存在 I3+ 离子。I3+ 离子的几何构型为_____。
(4)一定条件下 SbCl3 与 GaCl3 以物质的量之比为 l:l 混合得到一种固态离子化合物,其结构组成可能 为:(a) [GaCl2+ ][SbCl4- ]或(b) [SbCl2+ ][GaCl4- ],该离子化合物最可能的结构组成为_____ (填“a”或“b”),理由是_____。
(5)固态 PCl5 结构中存在 PCl4+ 和 PCl6 -两种离子,其晶胞如图所示。
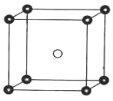
已知晶胞的边长为 a pm ,阿伏加德罗常数值用 NA表示。则 PCl4+ 和 PCl6 - 之间的最短距离为_____pm,固态 PCl5 的密度为_____gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的说法正确的是( )
A.金属单质在氧化还原反应中常作还原剂
B.金属在加热条件下都易与氧气反应
C.加热条件下铜与硫蒸气反应生成硫化铜
D.铁丝能在氯气中燃烧生成氯化亚铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,水只作氧化剂的是
A. NaH+H2O=NaOH+H2↑ B. Na2O+H2O=2NaOH
C. HCl+NaOH=NaCl+H2O D. 2F2+2H2O=4HF+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是一种重要的有机高分子材料,结构简式为: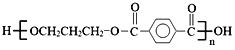 。合成M的一种途径如下:
。合成M的一种途径如下:
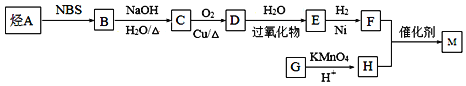
已知:①烃A在标准状况下的密度是1.875g·L-1;②CH3CH2CH=CH2![]() CH3CHBrCH=CH2;③R-CH=CH2+H2O
CH3CHBrCH=CH2;③R-CH=CH2+H2O![]() R-CH2CH2OH;④
R-CH2CH2OH;④![]() 。
。
回答下列问题:
(1)G的结构简式为___________;D中所含官能团的名称为____________________;
(2)A分子中最多有 __________个原子共平面;
(3)D→E反应类型为______________;
(4)写出下列反应的化学方程式:B→C:___________________________;F+H→M:_____________________________________________;
(5)满足以下条件的H的同分异构体有____________种。
①遇FeCl3溶液显紫色 ②可发生银镜反应 ③可与NaHCO3溶液生成CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com